醫用化學/原子結構
| 醫學電子書 >> 《醫用化學》 >> 原子結構和分子結構 >> 原子結構 |
| 醫用化學 |
|
|
自然界的物質種類繁多,性質各異。不同物質在性質上的差異是由於物質內部結構不同而引起的。在化學反應中,原子核不變,起變化的只是核外電子。要了解物質的性質及其變化規律,有必要先了解原子結構,特別是核外電子的運動狀態。
目錄 |
一、核外電子運動的特徵
我們知道,地球沿著固定軌道圍繞太陽運動,地球的衛星(月球或人造衛星)也以固定的軌道繞地球運轉。這些宏觀物體運動的共同規律是有固定的軌道,人們可以在任何時間內同時準確地測出它們的運動速度和所在位置。電子是一種極微小的粒子,質量為9.1×10-31kg,在核外的運動速度快(接近光速)。因此電子的運動和宏觀物體的運動不同。和光一樣,電子的運動具有微粒性和波動性的雙重性質。對於質量為m,運動速度為v的電子,其動量為:P=mv
其相應的波長為:
λ=h/P=h/mv (4-1)
式(4-1)中,左邊是電子的波長λ,它表明電子波動性的特徵,右邊是電子的動量P(或mv),它表明電子的微粒性特徵,兩者通過普朗克常數h聯繫起來。
實驗證明,對於具有波動性的微粒來說,不能同時準確地確定它在空間的位置和動量(運動速度)。也就是說電子的位置測得愈準時,它的動量(運動速度)就愈測不准,反之亦然。但是用統計的方法,可以知道電子在原子中某一區域內出現的幾率。
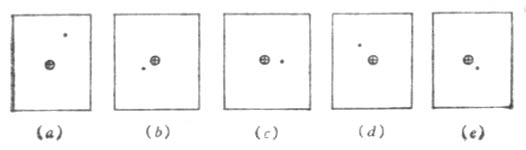
圖4-1 氫原子五次瞬間照像
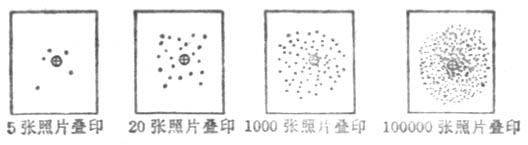
圖 4-2 若干張氫原子瞬間照片疊印
電子在原子核太空間各區域出現的幾率是不同的。在一定時間內,在某些地方電子出現的幾率較大。而在另一些地方出現的幾率較小。對於氫原子來說,核外只有一個電子。為了在一瞬間找到電子在氫原子核外的確切位置,假定我們用高速照相機先給某個氫原子拍五張照片,得到圖4-1所示的五種圖象,⊕ 代表原子核,小黑點表示電子。如果給這個氫原子照幾萬張照片,疊加這些照片(圖4-2)進行分析,發現原子核外的一個電子在核太空間各處都有出現的可能,但在各處出現的幾率不同。如果用小黑點的疏密來表示電子在核外各處的幾率密度(單位體積中出現的幾率)大小,黑點密的地方,是電子出現幾率密度大的地方;疏的地方,是電子出現幾率密度小的地方,如圖4-3所示。像這樣用小黑點的疏密形象地描述電子在原子核太空間的幾率密度分布圖象叫做電子云。所以電子云是電子在核外運動具有統計性的一種形象表示法。

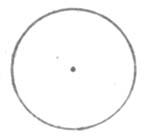
圖4-3 氫原子的電子云圖 4-4氫原子電子云界面圖
從圖4-3中可見,氫原子的電子云是球形的,離核越近的地方其電子云密度越大。但是由於離原子核越近,球殼的總體積越小,因此在這一區域內黑點的總數並不多。而是在半徑為53pm 附近的球殼中電子出現的幾率最大,這是氫原子最穩定狀態。為了方便,通常用電子云的界面表示原子中電子云的分布情況。所謂界面,是指電子在這個界面內出現的幾率很大(95%以上),而在界面外出現的幾率很小(5%以下)。
二、核外電子的運動狀態
電子在原子中的運動狀態,可n,l,m,ms四個量子數來描述。
(一)主量子數n
主量子數n是用來描述原子中電子出現幾率最大區域離核的遠近,或者說它是決定電子層數的。主量子數的n的取值為1,2,3…等正整數。例如,n=1代表電子離核的平均距離最近的一層,即第一電子層;n=2代表電子離核的平均距離比第一層稍遠的一層,即第二電子層。余此類推。可見n愈大電子離核的平均距離愈遠。
在光譜學上常用大寫拉丁字母K,L,M,N,O,P,Q代表電子層數。
| 主量子數(n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 電子層符號 | K | L | M | N | O | P | Q |
主量子數n是決定電子能量高低的主要因素。對單電子原子來說,n值愈大,電子的能量愈高。但是對多電子原子來說,核外電子的能量除了同主量子數n有關以外還同原子軌道(或電子云)的形狀有關。因此,n值愈大,電子的能量愈高這名話,只有在原子軌道(或電子云)的形狀相同的條件下,才是正確的。
(二)副量子數l
副量子數又稱角量子數。當n給定時,l可取值為0,1,2,3…(n-1)。在每一個主量子數n中,有n個副量子數,其最大值為n-1。例如n=1時,只有一個副量子數,l=0,n=2時,有兩個副量子數,l=0,l=1。余此類推。按光譜學上的習慣l還可以用s,p,d,f等符號表示。
| l | 0 | 1 | 2 | 3 |
| 光譜符號 | s | p | d | F |
副量子數l的一個重要物理意義是表示原子軌道(或電子云)的形狀。L=0時(稱s軌道),其原子軌道(或電子云)呈球形分布(圖4-5);l=1時(稱p軌道),其原子軌道(或電子云)呈啞鈴形分布(圖4-6);…
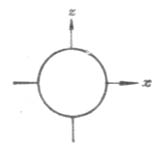
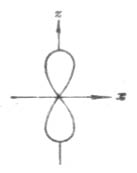
圖4-5 s電子云圖4-6 p電子
副量子數l的另一個物理意義是表示同一電子層中具有不同狀態的亞層。例如,n=3時,l可取值為0,1,2。即在第三層電子層上有三個亞層,分別為s,p,d亞層。為了區別不同電子層上的亞層,在亞層符號前面冠以電子層數。例如,2s是第二電子層上的亞層,3p是第三電子層上的p亞層。表4-1列出了主量子數n,副量子數l及相應電子層、亞層之間的關係。
表4-1 主量子數n,副量子數l及其相應電子層亞層之間的關係
| n | 電子層 | l | 亞層 |
| 1 | 1 | 0 | 1s |
| 2 | 2 | 0 | 2s |
| 1 | 2p | ||
| 3 | 3 | 0 | 3s |
| 1 | 3p | ||
| 2 | 3d | ||
| 4 | 4 | 0 | 4s |
| 1 | 4p | ||
| 2 | 4d | ||
| 3 | 4f |
前已述及,對於單電子體系的氫原子來說,各種狀態的電子能量只與n有關。但是對於多電子原子來說,由於原子中各電子之間的相互作用,因而當n相同,l不同時,各種狀態的電子能量也不同,l愈大,能量愈高。即同一電子層上的不同亞層其能量不同,這些亞層又稱為能級。因此副量子數l的第三個物理意義是:它同多電子原子中電子的能量有關,是決定多電子原子中電子能量的次要因素。
(三)磁量子數m
磁量子數m決定原子軌道(或電子云)在空間的伸展方向。當l給定時,m的取值為從-l到+l之間的一切整數(包括0在內),即0,±1,±2,±3,…±l,共有2l+1個取值。即原子軌道(或電子云)在空間有2l+1個伸展方向。原子軌道(或電子云)在空間的每一個伸展方向稱做一個軌道。例如,l=0時,s電子云呈球形對稱分布,沒有方向性。m只能有一個值,即m=0,說明s亞層只有一個軌道為s軌道。當l=1時,m可有-1,0,+1三個取值,說明p電子云在空間有三種取向,即p亞層中有三個以x,y,z軸為對稱軸的px,py,pz軌道。當l=2時,m可有五個取值,即d電子云在空間有五種取向,d亞層中有五個不同伸展方向的d軌道(圖4-7)。
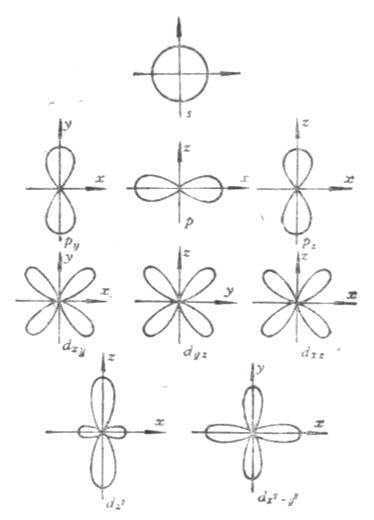
圖4-7 s,p,d電子云在空間的分布
n,l相同,m 不同的各軌道具有相同的能量,把能量相同的軌道稱為等價軌道。
(四)自旋量子數ms
原子中的電子除繞核作高速運動外,還繞自己的軸作自旋運動。電子的自旋運動用自旋量子數ms表示。ms 的取值有兩個,+1/2和-1/2。說明電子的自旋只有兩個方向,即順時針方向和逆時針方向。通常用「↑」和「↓」表示。
綜上所述,原子中每個電子的運動狀態可以用n,l,m,ms四個量子數來描述。主量子數n決定電子出現幾率最大的區域離核的遠近(或電子層),並且是決定電子能量的主要因素;副量子數l決定原子軌道(或電子云)的形狀,同時也影響電子的能量;磁量子數m決定原子軌道(或電子云)在空間的伸展方向;自旋量子數ms決定電子自旋的方向。因此四個量子數確定之後,電子在核太空間的運動狀態也就確定了。
三、核外電子的排布規律
(一)最低能量原理
所謂最低能量原理是,原子核外的電子,總是儘先佔有能量最低的原子軌道,只有當能量較低的原子軌道被佔滿後,電子才依次進入能量較高的軌道,以使原子處於能量最低的穩定狀態。
原子軌道能量的高低為:
1.當n相同,l不同時,軌道的能量次序不s<p<d<f。例如,E3S<E3P<E3d。
2.當n不同,l相同時,n愈大,各相應的軌道能量愈高。例如,E2S<E3S<E4S。
3.當n和l都不相同時,軌道能量有交錯現象。即(n-1)d軌道能量大於ns軌道的能量,(n-1)f軌道的能量大於np軌道的能量。在同一周期中,各元素隨著原子序數遞增核外電子的填充次序為ns,(n-2)f,(n-1)d,np。
核外電子填充次序如圖4-8所示。
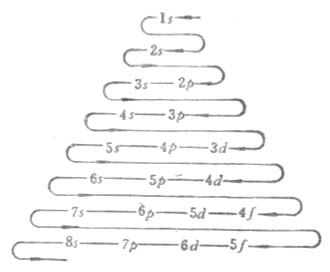
圖4-8 電子填充的次序
(二)鮑里(Pauli)不相容原理
鮑里不相容原理的內容是:在同一原子中沒有四個量子數完全相同的電子,或者說在同一原子中沒有運動狀態完全相同的電子。例如,氦原子的1s軌道中有兩個電子,描述其中一個原子中沒有運動狀態的一組量子數(n,l,m,ms)為1,0,0,+1/2,另一個電子的一組量子數必然是1,0,0,-1/2,即兩個電子的其他狀態相同但自旋方向相反。根據鮑里不相容原理可以得出這樣的結論,在每一個原子軌道中,最多只能容納自旋方向相反的兩個電子。於是,不難推算出各電子層最多容納的電子數為2n2個。例如,n=2時,電子可以處於四個量子數不同組合的8種狀態,即n=2時,最多可容納8個電子,見下表。
| N | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| L | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 |
| M | 0 | 0 | 0 | 0 | +1 | +1 | -1 | -1 |
| ms | +1/2 | -1/2 | +1/2 | -1/2 | +1/2 | -1/2 | +1/2 | -1/2 |
在等價軌道中,電子儘可能分佔不同的軌道,且自旋方向相同,這就叫洪特規則。
洪特規則實際上是最低能量原理的補充。因為兩個電子同佔一個軌道時,電子間的排斥作用會使體系能量升高,只有分佔等價軌道,才有利於降低體系的能量。例如,碳原子核外有6個電子,除了有2個電子分布在1s軌道,2個電子分布在2s軌道外,另外2個電子不是佔1個p軌道,而是以自旋相同的方向分佔能量相同,但伸展方向不同的兩個2p軌道。碳原子核外6個電子的排布情況如下:

作為洪特規則的特例,等價軌道全充滿,半充滿或全空的狀態是比較穩定的。全充滿、半充滿和全空的結構分別表示如下:
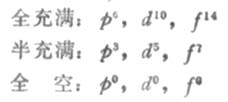
用洪特規則可以解釋為什麼Cr原子的外層電子排布為3d54s1而不是3d44s2,Cu原子的外層電子排布為3d104s1而不是3d94s2。
應該指出,核外電子排布的原理是從大量事實中概括出來的一般規律,絕大多數原子核外電子的實際排布與這些原理是一致的。但是隨著原子序數的增大,核外電子排布變得複雜,用核外電子排布的原理不能滿意地解釋某些實驗的事實。在學習中,我們首先應該尊重事實,不要拿原理去適應事實。也不能因為原理不完善而全盤否定原理。科學的任務是承認矛盾,不斷地發展這些原理,使之更加趨於完善。
四、元素的電負性
元素的原子在分子中吸引電子的能力叫元素的電負性。元素的電負性愈大,表示該元素原子吸引電子的能力愈大,生成陰離子的傾向愈大。反之,吸引電子的能力愈小,生成陽離子的傾向愈大。表4-2列出了元素的電負性數值。元素的電負性是相對值,沒有單位。通常規定氟的電負性為4.0(或鋰為1.0),計算出其他元素的電負性數值。從表4-2可以看出,元素的電負性具有明顯的周期性。電負性的周期性變化和元素的金屬性、非金屬性的周期性變化是一致的。同一周期內從左到右,元素的電負性逐漸增大,同一主族內從上至下電負性減小。在副族中,電負性變化不規則。在所有元素中,氟的電負性(4.0)最大,非金屬性最強,鈁的電負性(0.7)最小,金屬性最強。一般金屬元素的電負性小於2.0,非金屬元素的電負性大於2.0,但兩者之間沒有嚴格的界限,不能把電負性2.0作為劃分金屬和非金屬的絕對標準。
表4-2 元素的電負性
| Li | Be | H | B | C | N | O | F | |||||||||
| 1.0 | 1.5 | 2.1 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 | |||||||||
| Na | Mg | Al | Si | P | S | Cl | ||||||||||
| 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br |
| 0.8 | 1.0 | 1.3 | 1.5 | 1.6 | 1.6 | 1.5 | 1.8 | 1.8 | 1.9 | 1.9 | 1.6 | 1.6 | 1.8 | 2.0 | 2.4 | 2.8 |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I |
| 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 1.9 | 2.2 | 2.2 | 2.2 | 1.9 | 1.7 | 1.7 | 1.8 | 1.9 | 2.1 | 2.5 |
| Cs | Ba | La~Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At |
| 0.7 | 0.9 | 1.1~1.2 | 1.3 | 1.5 | 1.7 | 1.9 | 2.2 | 2.2 | 2.2 | 2.4 | 1.9 | 1.8 | 1.8 | 1.9 | 2.0 | 2.2 |
| Fr | Ra | Ac | Th | Ha | U | Np~No | ||||||||||
| 0.7 | 0.9 | 1.1 | 1.3 | 1.4 | 1.4 | 1.4~1.3 |
素電負性的大小,不僅能說明元素的金屬性和非金屬性,而且對討論化學鍵的類型,元素的氧化數和分子的極性等都有密切關係。
| 關於「醫用化學/原子結構」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |