醫用化學/分子結構
| 醫學電子書 >> 《醫用化學》 >> 原子結構和分子結構 >> 分子結構 |
| 醫用化學 |
|
|
所謂分子結構通常包括下面一些內容:分子中直接相鄰的原子間的強相互作用力,即化學鍵問題,分子的空間構型問題;分子之間還有一種弱的相互作用力,即分子間力問題;此外分子間或分子內的一些原子間還可能形成氫鍵。
本節主要簡介雜化軌道理論,有關氫鍵的問題留在下一節討論。
一、化學鍵的概念
分子或晶體中相鄰原子間強烈的相互作用力稱為化學鍵。化學鍵的基本類型有:離子鍵(電價鍵)、共價鍵、配價鍵和金屬鍵等。
以陽離子和陰離子之間靜電引力形成的化學鍵 叫離子 鍵。
分子中原子間通過共享電子對所形成的化學鍵為共價鍵。
配價鍵是一種特殊的共價鍵,其共享電子對是一個原子單獨提供的。這種由一個原子單獨提供一對電子與另一個原子共享所形成的共價鍵,叫配位共價鍵,簡稱配價鍵。
自1916年劉易斯提出經典的共價鍵理論以來,共價鍵理論有了很大的發展。現代共價鍵理論有兩種,一是價鍵理論,二是分子軌道理論。本書不介紹軌道理論。
(一)價鍵理論的基本要點
價鍵理論,又稱電子配對法,其基本要點如下:
1.具有自旋相反的未成對電子的兩個原子相互接近,可以形成穩定的共價鍵。
如果A、B兩個原子各有一個自旋相反的未成對的電子,那麼這兩個未成對電子可以相互配對形成穩定的共價鍵,這對電子為A、B兩原子所共有。如果A、B各有兩個或三個未成對的電子,則自旋相反的單電子可兩兩配對形成共價鍵或叄鍵。
如果A原子有兩個未成對電子,B原子有一個未成對電子,那麼一個A原子能與兩個B原子結合形成AB2型分子。
2.原子中未成對的電子數等於原子所能形成的共價鍵數目。
共價鍵是由成鍵原子中自旋相反的未成對電子配對形成的。一個原子的一個電子和另一個原子的一個電子配對以後,不能再和第二個電子配對。因為這時其中必有兩個電子的自旋方向相同而相斥。也就是說一個原子所能形成共價鍵的數目是一定的。原子中未成對的電子數等於原子所能形成的共價鍵數目,這就是共鍵價的飽和性。例如,H原子只有一個未成對電子,它和另一個H原子的未成對電子配對後,就不能再與第二個H原子的電子配對了。
3.成鍵電子的電子云重疊越多,核間電子子云密度越大,形成的共價鍵越牢固。
共價鍵的生成是由於自旋相反的單電子相互配對,電子云重疊的結果。因此,當兩個原子形成分子時,電子云重疊的程度越大,則兩原子間的電子云密度越大,生成的共價鍵越牢固,所以,在形成共價鍵時,電子云總是儘可能達到晨大程度的重疊,這叫電子云最大重疊原理。
根據電子云最大重疊原理,在形成共價鍵時,原子間總是儘可能沿著電子云最大重疊方向成鍵。s電子云呈球形對稱分布,p、d、f電子云在空間都有一定的伸展方向。在形成共價鍵時,除了s電子云和s電子云可以在任何方向上都能達到最大程度的重疊外,p、d電子云的重疊,只有在一定方向上才能使電子云有最大程度的重疊。即共價鍵是有方向性的。例如,當氫原子1s電子云和氯原子的3p電子云重疊形成HCL分子時,氫原子的1s電子云總是沿著氯原子未成對電子的3p電子云對稱軸方向作最大程度的重疊(圖4-9(a))。其他方向都不能形成穩定的分子(圖4-9(b)(c))。
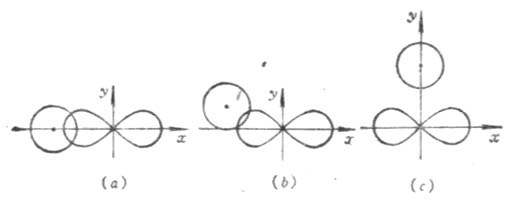
圖4-9 氫原子的1s電子云與氧原子的3Pχ電子云的三種重疊情況
(二)共價鍵的類型
共價鍵有兩種成鍵方式。一種是電子云以:「頭碰頭」方式相重疊,電子云及重疊部分沿鍵軸(兩核間連線)呈圓柱形對稱分布,重疊部分繞軸旋轉任何角度形狀不會改變,這種鍵叫σ鍵。另一種是成鍵的兩個電子云的對稱軸相平行,以「肩並肩」方式相重疊,電子云重疊部分對通過鍵軸的一個面具有對稱性,這種鍵稱為π鍵。
例如在N2分子中,氮原子的電子層結構為1s22s22p1x2p1y2p1z三個未成對的p電子分佔三個互相垂直的p軌道。當兩個氮原子結合成N2分子時,px電子云沿x軸方向以「頭碰頭」方式重疊形成一個σ鍵,每個原子剩下的兩個p電子云不能再沿x軸方向「頭碰頭」重疊,只能讓p電子云的對稱軸平行,以「肩並肩」方式重疊形成兩個π鍵。如圖4-10。
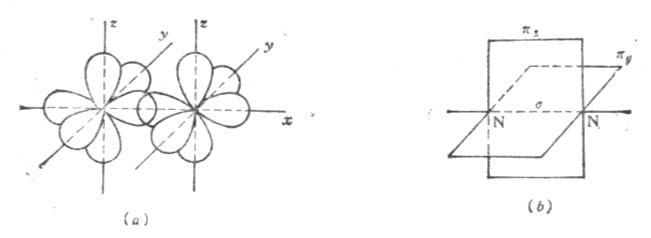
圖4-10 N2分子形成示意圖
由於σ鍵電子云重疊程度較π鍵大,因而σ鍵比π鍵牢固。一般來說,π鍵容易斷開,化學活潑性較強。π鍵不能單獨存在,只能與σ鍵共存於具有雙鍵或叄鍵的分子中。σ鍵不易斷開,是構成分子的骨架,可單獨存在於兩原子間。通常在以共價鍵結合的兩原子間只能有一個σ鍵。
二、雜化軌道理論
價鍵理論比較簡明地闡明了共價鍵的本質,共價鍵的飽和性和方向性。但在解釋分子的空間結構方面卻遇到了困難。例如,經實驗測知,甲烷分子具有正四面體的空間構型,如圖4-11所示。圖中實線代表C-H鍵,虛線表示CH4分子具有正四面體的空間構型。碳原子位於四面體的中心,與四個氫原子形成四個等同的C-H鍵,指向四面體的頂點,兩個C-H鍵間夾角(<HCH)為109°28』。
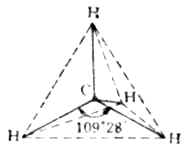
圖4-11 CH4分子構型
碳原子的外層電子構型是2s22p1x2p1y有兩個未成對的p電子,按照價鍵理論,碳只能與兩個氫原子形成兩個共價鍵。如果考慮將碳原子的一個s電子激發到2p空軌道上去,則碳原子有四個未成對電子(一個s電子和三個p電子),可與四個氫原子的1s電子配對形成四個C-H鍵。從能量觀點上看,2s電子激發到2p軌道所需要的能量(402kJ.mol-1)可能被多形成兩個C-H鍵所放出的能量(410KJ.mol-1)所補償而余。由於碳原子的2s電子和2p電子的能量不同,形成的四個C-H鍵也應當不同,這與實驗事實不符。為了解決這個矛盾,1931年鮑林(Pauling)和斯萊脫(Slater)提出了雜化軌道理論,進一步發展和豐富了現代價鍵理論。
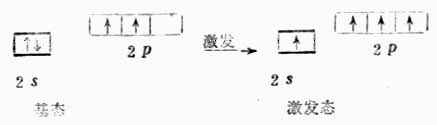
(一)雜化軌道理論的基本要要點
1.在成鍵過程中,由於原子間的相互影響,同一原子中參加成鍵的幾個能量相近的原子軌道可以進行混合,重新分配能量和空間方向,組成數目相等的新原子軌道。這種軌道重新組合的過程稱為軌道雜化,簡稱雜化。所組成的新原子軌道叫做雜化軌道。
2.雜化軌道之間互相排斥,力圖在空間取得最大的鍵角,使體系能量降低。原子軌道雜化以後所形成的雜化軌道更有利於成鍵。因為雜化後原子軌道的開頭髮生了變化,如s軌道和p軌道雜化形成的雜化軌道,使本來平分在對稱兩個方向上的p軌道比較集中在一個向上,變成一頭大一頭小,成鍵時在較大一頭重疊,有利於最大重疊。因此雜化軌道的成鍵能力比單純軌道的成鍵能力強。
(二)雜化軌道類型
根據原子軌道的種類和數目不同,可以組成不同類型的雜化軌道。這裡我們只介紹s軌道和p軌道之間的雜化。
1.Sp雜化
一個s軌道和一個p軌道雜化可組成兩個sp雜化軌道。每個sp雜化軌道各含有1/2s和1/2p成分。兩個雜化軌道夾角為180°。
兩個sp雜化軌道的對稱軸在同一條直線上,只是方向相反(圖4-12)。因此sp雜化軌道又叫直線形雜化軌道。
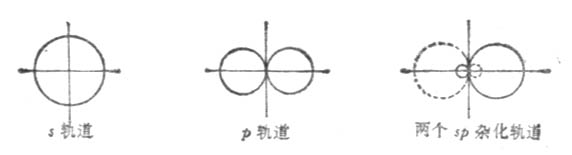
圖 4-12 sp雜化軌道的形成
氣態BeCL2是直線形分子,鈹原子的電子層結構為1s22s2,似乎不會形成共價鍵。但實際上鈹可與氯氣反應生成BeCL2共價分子。根據雜化軌道理論,鈹原子成鍵時,2s軌道上的一個電子先被激發到一個空的2p軌道上去,然後由含有一個未成對電子的2s軌道和2p軌道進行sp雜化形成能量相等夾角為180°的兩個sp雜化軌道。兩個雜化軌道再分別與兩個氯原子的3p軌道重疊,形成兩個互為180°的Be-Cl鍵,它們是(sp-p)σ鍵。因此BeCL2是直線形分子(圖4-13)。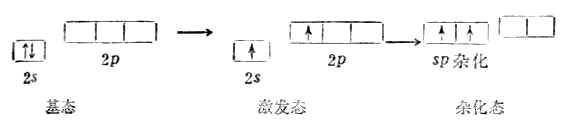
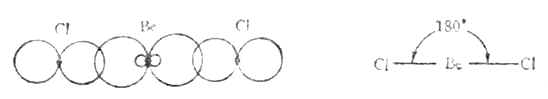
圖4-13 BeCL2分子型
2.sp2雜化
一個s軌道和兩個p軌道雜化可組成三個sp2雜化軌道。每個sp2雜化軌道有1/3s成分,2/3p成分。兩個sp2雜化軌道間的夾角120°。
三個sp2雜化軌道的取向是指向平面三角形的三個頂角,因此sp2雜化軌道又叫平面三角形雜化軌道(圖4-14)。

圖4-14 三個sp2雜化軌道
BF3是平面三角形分子。硼原子的價電子結構為2s22p1。當硼與氟反應時,硼原子2s軌道上的一個電子先激發到空的2p軌道上去,然後一個s軌道和兩個2p軌道進行sp2雜化形成三個夾角為120°的sp2雜化軌道。每個sp2雜化軌道與F原子的一個p軌道重疊組成一個(sp2-p)σ鍵。BG3是平面三角形結構。分子中四個原子處在同一平面上,B原子位於中心(圖4-15)。
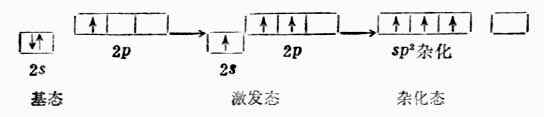
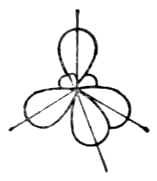
圖4-15 BF分子構成 圖4-16四個sp雜化軌道
3.sp3雜化
一個s軌道和三個p軌道雜化形成四個sp3雜化軌道,每個sp3雜化軌道含有1/4s和3/4p成分。每兩個雜化軌道間的夾角為109°28』。
四個sp3雜化軌道的取向是指向正四面體的四個頂角。所以sp3雜化軌道也稱正四面體雜化軌道(圖4-16)。
在形成CH4分子時,碳原子的一個s電子先激發到空的2p軌道上去然後一個s軌道和三個p軌道雜化組成四個等同的sp3雜化軌道。四個氫原子的1s軌道分別同碳原子的四個sp3雜化軌道重疊,組成四個(sp3-p)σ鍵,形成CH4分子。
| 關於「醫用化學/分子結構」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |