醫用化學/一元弱酸弱鹼的離解平衡
| 醫學電子書 >> 《醫用化學》 >> 電解質溶液 >> 電解質在溶液中的離解 >> 一元弱酸弱鹼的離解平衡 |
| 醫用化學 |
|
|
|
(一)離解度和離解常數
一元弱酸弱鹼(如HOAc,NH3等)是弱電解質,在溶液中只能部分離解。離解程度用離解度表示。
離解度是指溶液中已經離解的電解質的分子數占電解質總分子數(已離解的和未離解的)的百分數。通常用α表示。

一元弱酸HA存在以下的離解平衡:
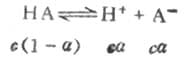
平衡濃度為
c(1-α) cα cα其中c為HA的總濃度,α為離解度。
離解常數KI可表示為
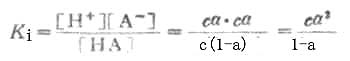 (2-1)
(2-1)
KI在一定溫度下為一常數,不能隨濃度變化而變化。弱酸的離解常數習慣上用Ka表示,弱鹼的離解常數用Kb表示。
如果弱電解質離解度α很少,則
1-α≈1
這時式(2-1)為
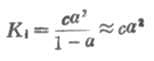
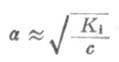 (2-2)
(2-2)
從式(2-2)可以看出,在一定溫度下,同一弱電解質的離解度大約與溶液濃度的平方根成反比,即離解度隨溶液的稀釋而升高。這條說明溶液濃度與離解度關係的定律,叫做稀釋定律。式(2-2)叫做稀釋定律公式。利用此公式可以進行有關離解試或離解常數的計算。
例1在25℃時,已知(1)0.1mol.L-1HOAc的離解度為1.32%;(2)0.2mol.L-1HOAc的離解度為0.93%,求HOAc的離解常數。
解:(1)
(2)
從例1可以看出,對不同濃度HOAc溶液,在一定溫度下,所計算出來的離解常數基本是一致的。表2-1是HOAc溶液在25℃時,不同濃度的離解度以及由離解度計算出來的離解常數值。
表2-1 25℃,不同濃度醋酸的離解度和離解常數
| 濃度/mol.L-1 | 離解度/% | 離解常數 |
| 0.001 | 12.4 | 1.76×10-5 |
| 0.01 | 4.1 | 1.76×10-5 |
| 0.02 | 2.96 | 1.80×10-5 |
| 0.1 | 1.32 | 1.76×10-5 |
| 0.2 | 0.93 | 1.76×10-5 |
利用離解常數可以計算一定濃度某弱酸溶液中的H+濃度,或計算弱鹼溶液中的OH-=濃度。
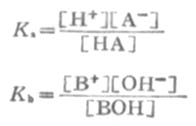
式中HA為弱酸,BOH為弱鹼。
在濃度為c的弱酸中,[H+]=cα,即α=[H+]/c,又根據稀釋定律,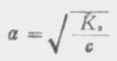 , 則
, 則
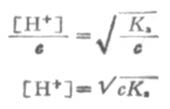 (2-3)
(2-3)
同理,在濃度為c的弱鹼溶液中,
![]() (2-4)
(2-4)
根據式(2-3)和式(2-4),可以計算一定濃度的弱酸或弱鹼的[H+]或[OH-]。
離解常數的大小用以衡量酸或鹼的強弱程度。酸或鹼越弱,它們的離解常數值就越小。一般認為KI在10-5至10-9範圍內的電解質是弱電解質;KI值小於10-10時是極弱電解質。
(二)影響離解平衡的因素
弱酸和弱鹼的離解平衡都是暫時的、相對的動態平衡。當外界條件改變時,離解平衡像其它平衡一樣,會發生移動,結果弱酸和弱鹼的離解程度都有所增減。因此,可以應用平衡移動原理,通過改變外界條件,控制弱酸和弱鹼的離解程度。外界條件主要指溫度,同離子效應和鹽效應的影響。
1.溫度的影響
溫度變化能使離解平衡發生移動,這種移動是通過離解常數的改變實現的,但在常溫範圍內變化不大。
2.同離子效應
離子濃度的改變,對弱酸和弱鹼離解程度的影響極為顯著。
例如,在醋酸溶液中加入一些醋酸鈉,由於醋酸鈉是強電解質,在水溶液中完全離解Na+OAc-,這樣溶液中[OAc-]增大,使![]()
離解平衡向左移動,從而降低了醋酸的離解度和溶液中的H+濃度。
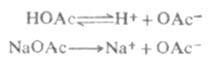
又如,在氨水中加入一些氯化銨,由於氯化銨是強電解質,在水溶液中完全離解成NH4+和CL-,這樣溶液中[NH4+]增大,使離解平衡向左移動,從而降低了氨水的離解度和溶液中的OH-濃度。
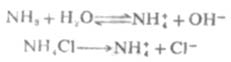
由此可以得出結論,在弱電解質溶液中,加入與弱電解質具有相同離子的強電解質,使弱電解質的離解度降低的效應,稱為同離子效應。
3.鹽效應
在弱電解質溶液中,加入與弱電解質沒有相同離子的強電解質,而使弱電解質的離解度略微增大的效應,稱為鹽效應。
鹽效應的產生,是由於強電解質的加入,使溶液中離子間的相互牽製作用增強,離子結合成分子的機會減少,降低了分子化的程度,因而達到平衡時,弱電解質的離解度比未加入強電解質時略微大些。
例如,在0.1mol.L-1HOAc溶液中加入NaCL晶體,使NaCL的濃度為0.1mol.L-1時,[H+]不是1.32×10-3mol.L-1,而是1.70×10-3mol.L-1,離解度不是1.32%而是1.70%.
應該指出,在發生同離子效應的同時,必然伴隨著鹽效應的發生.這兩個效應對弱電解質離解度影響不同.鹽效應可以使弱電解質的離解度增大一些,而同離子效應可以使弱電解質的離解度大大降低.這說明同離子效應和鹽效應對溶液酸鹼性的影響是不能相提並論的.因此,對稀溶液來說,如不考慮鹽效應,是不會引起很大誤差的.
| 關於「醫用化學/一元弱酸弱鹼的離解平衡」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |