醫用化學/強電解質在溶液中的離解
| 醫學電子書 >> 《醫用化學》 >> 電解質溶液 >> 電解質在溶液中的離解 >> 強電解質在溶液中的離解 |
| 醫用化學 |
|
|
|
(一)離子互吸學說
稀釋定律適用於弱電解質溶液,而不適用於強電解質溶液。為了闡明強電解質在溶液中的實際情況,德拜(Debye)和休克爾(Huckel)提出了離子互吸學說,又叫完全電離學說。這種學說認為,強電解質在水溶液中完全離解成離子,離子在水溶液中並不完全自由。帶異號電荷的離子相互吸引,距離近的吸引力大;帶同號電荷的離子相互排斥,距離近的排斥力大。因此,離陽離子越近的地方,陽離子越少,陰離子越多;離陰離子越近的地方,陰離子越少,陽離子越多。總的結果是,任何一個離子都好像被一層球形對稱的異號電荷離子所包圍著。這層在中心陽離子周圍所構成的球體,叫做離子氛。如圖2-1所示,位於球體中心的離子稱為中心離子,在中心陽離子周圍有陰離子氛,在中心陰離子周圍有陽離子氛。
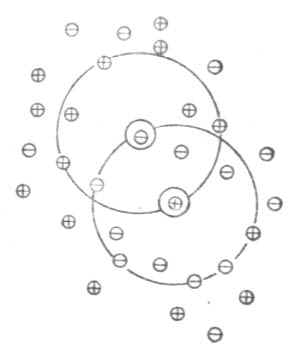
圖2-1 離子氛示意圖
在離子氛的影響下,溶液中的離子受到帶有相反電離子荷氛的影響,而不能完全自由活動。使強電解質溶液中的離子不能百分之百地發揮應有的效能。因此,實測的離解度總是小於100%,這不是強電解質的真實離解度,它反映了溶液中離子間相互影響的程度,我們把這種離解度稱為「表現離解度」。而強電解質的真實離解度是100%。
後來發現在強電解質溶液中,不但有離子氛存在,而且相反電荷的離子還可以締合成離子對作為一個獨立單位而運動。有的離子對沒有導電能力。離子對在遇到強力碰撞時,可以分開,隨後又可以重新形成新的離子時對。離子對的存在也使自由離子的濃度下降,導致溶液的導電能力下降。
離子氛和離子對的形成顯然與溶液的濃度和離子電荷有關。溶液愈濃,離子所帶的電荷愈多,上述效應愈顯著。
如取不同濃度的KCL溶液,測定它的離解度(α)值,根據稀釋定律求得相就的「離解常數」值如表2-3。
表2-3 18℃,不同濃度KCL溶液的「離解度」和「離解常數」
| 濃度/mol.L-1 | 離解度/% | 離解常數 |
| 0.01 | 94.2 | 0.152 |
| 0.1 | 86.2 | 0.536 |
| 1.0 | 75.6 | 2.34 |
| 2.0 | 71.2 | 3.52 |
由表2-3可以看出,強電解質」離解常數」K隨溶液濃度的不同變化很大,這說明強電解質不存在離解常數.也就是說強電解質在溶液中是完全離解的,不存在離解平衡,因而就不存在離解度和離解常數.稀釋定律是以弱電解質的可逆性過程為基礎推導得出的,所以它不適用於強電解質溶液,不能客觀地闡明強電解質在溶液中的實際情況.
(二)離子活動和活度係數
由於強電解質溶液中存在離子氛和離子對,每個離子不能完全自由地發揮它在導電等方面的作用,路易斯(Lewis)就提出了活度的概念.離子活度是溶液中離子的有效濃度.它電漿和活度係數的乘積.設離子的濃度為c,活度係數為f,則離子的活度(α)為:α=fc (2-5) 或f=α/c
活度係數f反映了離子間存在著相互影響這一因素.由於離子的活度一般都比濃度小,所以f一般都小於1.活度係數大,表示離子牽製作用弱,離子活動的自由程度大.溶液愈稀,活度係數愈接近於1.當溶液無限稀釋時,活度係數等於1,這時離子的運動完全自由,離子活動就等於離子濃度.
因為電解質溶液中必定同時存在陽離子和陰離子,實驗無法獨測出陽離子的活度係數或陰離子的活度係數.但實驗可以測出一個電解質的陽/陰離子的平均活度係數(f±).強電解質溶液的活度一般指溶液的平均活度(α±)
α±= f±×c
表2-4列舉了25℃時,一些強電解質的離子平均活度係數.
表2-4 一些強電解質的離子平均活度係數(25℃)
| 電解質 | C/mol.L-1 | ||||||
| 0.001 | 0.005 | 0.01 | 0.05 | 0.1 | 0.5 | 1.0 | |
| HCL | 0.966 | 0.928 | 0.904 | 0.803 | 0.796 | 0.758 | 0.809 |
| KOH | 0.96 | 0.92 | 0.90 | 0.82 | 0.80 | 0.73 | 0.76 |
| KCL | 0.965 | 0.927 | 0.901 | 0.815 | 0.769 | 0.651 | 0.606 |
| H2SO4 | 0.630 | 0.639 | 0.544 | 0.340 | 0.265 | 0.154 | 0.130 |
| Ca(NO3)2 | 0.88 | 0.77 | 0.71 | 0.54 | 0.48 | 0.38 | 0.35 |
| CuSO4 | 0.74 | 0.53 | 0.41 | 0.21 | 0.16 | 0.068 | 0.047 |
例3 已知25℃時,0.1mol.L-1KCL溶液中,離子的平均活度係數為0.769,求離子的平均活度.
解:已知f±=0.769 c=0.1 mol.L-1
α±=0.769×0.1=0.0769×mol.L-1
(三)離子強度
溶液中離子的活度係數不僅與它的濃度有關,並且還與溶液中其它各種離子的總濃度和離子的電荷數有關,但與離子的種類無關.因此,溶液中離子的濃度和離子的電荷數就成為影響離子活度係數的主要因素.為了闡明離子濃度和離子電荷數對離子活度的影響,引入了離子度的概念.離子強度表示溶液中離子所產生的電場強度.它是溶液中各種離子的量濃度乘以離子電荷數的平方總和的二分
![]() (2-6)
(2-6)
式中,I代表溶液的離子濃度;c是離子的量濃度;z是離子的電荷數.
例4 求0.01mol.L-1NaCL溶液的離子強度.
解:I=1/2×(0.01×12+0.01×12)=0.01
例5 溶液中含有0.05mol.L-1NaCL和0.01 mol.L-1KCL,求該溶液的離子強度.
解:I=1/2×(0.05×12+0.05×12+0.01×12+0.01×12)=0.06
離子活度係數隨溶液中離子強度的改變而顯著改變,表2-5列出了離子強度和平均活度係數的關係.溶液中離子強度越大,離子間的相互影響越強,離子活動受到的限制就越大。只有當溶液接近於無限稀釋時,離子強度趨近於零,離子才能完全自由活動,這時離子的活度生活費數就接近於1,即離子活度就接近於離子的真實濃度。
表2-5 不同離子強度時離子的活度係數(25℃)
| 活度係數 離子強度 |
電 荷 數 | |||
| 1 | 2 | 3 | 4 | |
| 1×10-4 | 0.99 | 0.95 | 0.90 | 0.83 |
| 2×10-4 | 0.98 | 0.94 | 0.87 | 0.770.77 |
| 5×10-4 | 0.97 | 0.90 | 0.80 | 0.67 |
| 1×10-3 | 0.96 | 0.86 | 0.73 | 0.56 |
| 2×10-3 | 0.95 | 0.81 | 0.64 | 0.45 |
| 5×10-3 | 0.92 | 0.72 | 0.51 | 0.30 |
| 1×10-2 | 0.89 | 0.63 | 0.39 | 0.19 |
| 2×10-2 | 0.87 | 0.57 | 0.28 | 0.12 |
| 5×10-2 | 0.81 | 0.44 | 0.15 | 0.04 |
| 0.1 | 0.78 | 0.33 | 0.08 | 0.01 |
| 0.2 | 0.70 | 0.24 | 0.04 | 0.003 |
| 0.3 | 0.66 | 0.62 | - | - |
| 0.5 | 0.62 | - | - | - |
採用離子強度的目的,是因為離子的活度係數的測定方法一般比較複雜,不容易測定。但是,離子活度係數與離子強度間卻存在著一定的聯繫,並且離子強度很容易由離子的濃度與其所帶電荷而求得。在測定離解迷路數時等精密工作中,要求對離子的有效濃度作精確計算,這就需要由離子將濃度換算成活度。但在一般有關稀溶液的計算中,可直接換算成活度。
| 關於「醫用化學/強電解質在溶液中的離解」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |