醫學免疫學/B細胞的發育
| 醫學電子書 >> 《醫學免疫學》 >> 免疫細胞(二):淋巴細胞系 >> B細胞 >> B細胞的發育 |
| 醫學免疫學 |
|
|
|
鳥類的法氏囊是B細胞分化的場所。哺乳類動物在胚胎早期,B細胞分化的最早部位是卵黃囊,此後在脾和骨髓,出生後則在骨髓內分化成熟。
B細胞分化過程可分為二個階段,即抗原非依賴期和抗原依賴期。在抗原非依賴期,B細胞分化與抗原刺激無關,主要在中樞免疫器官內進行。而抗原依賴期是指成熟B細胞受抗原刺激後,可繼續分化為合成和分泌抗體的漿細胞階段,主要在周圍免疫器官內進行。
(一)骨髓微環境
早期B細胞的增殖與分化,其發生是與骨髓造血微環境(hemopoietic inductive microenviroment,HIM)密切相關。HIM是由造血細胞以外的基質細胞(stroma cell)及其分泌的細胞因子和細胞外基質(extracellular matrix,ECM)組成。基質細胞可包括巨噬細胞、血管內皮細胞、纖維母細胞、前脂肪細胞、脂肪細胞等。由間質細胞分泌的纖粘連蛋白、膠原蛋白及層粘連蛋白等形成細胞外基質,此外還可合成和分泌眾多的細胞因子。HIM的作用主要是通過細胞因子可調節造血細胞的增殖與分化,通過粘附分子可使造血細胞與間質細胞相互直接接觸,有利於造血細胞的定位和成熟細胞的遷出(表8-12,圖8-5)。
表8-12 骨髓微環境與造血幹細胞的相互作用
| 基質細胞 | 相互作用的媒介分子 細胞外基質 |
細胞因子 |
| 纖維母細胞 | 纖粘連蛋白 | SCF |
| 巨噬細胞 | 層粘連蛋白 | G-CSF |
| 內皮細胞 | 膠原蛋白等 | M-CSF |
| 前脂肪細胞 | GM-CSF | |
| 脂肪細胞 | IL-4 | |
| IL-6 | ||
| IL-7 | ||
| TGF-β |
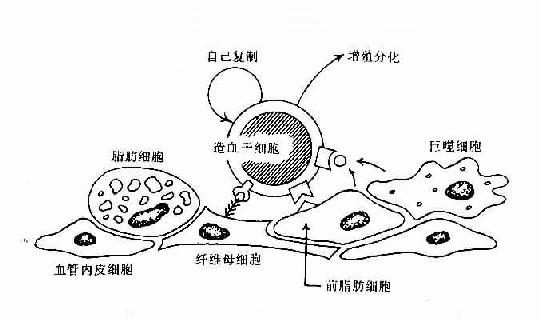
圖8-5 骨髓基質細胞與造血幹細胞相互作用示意圖
(二)B細胞在骨髓內的發育
B細胞與其它血細胞一樣,也是由骨髓內多能幹細胞分化而來。過去曾認為T和B細胞可能來自共同的淋巴樣幹細胞,但迄今對基分化途徑、分化部位以及其特異的表面標誌尚未明確,有待進一步研究。
已證明,B細胞在骨髓內的發育,可經過祖B細胞(pro-B)、前B細胞(pre-B)、不成熟B細胞(immatureB)及成熟B細胞(mature)幾個階段。成熟B細胞釋放至周圍淋巴組織,構成B細胞庫,在此階段經抗原刺激後,可繼續分化為合成和分汔抗體的漿細胞,即抗原依賴的分化階段。
B細胞在骨髓內分化各階段的主要變化為免疫球蛋白基因的重排和膜表面標誌的表達。B細胞在發育分化過程中,同樣也經歷選擇作用,以除去非功能性基因重排B細胞和自身反應性B細胞,形成周圍成熟的B細胞庫(表8-13,圖8-13)。
表8-13 B細胞分化特徵
| Pro-B | Pre-B | 不成熟B | 成熟B | PC | |
| 抗原依賴 | - | - | + | + | - |
| 基質細胞依賴(配體?) | + | + | - | - | - |
| H鏈V基質重排 | - | DJ→VDJ | VDJ | VDJ | - |
| H鏈蛋白 | μ- | μ+ | μ+ | μ+δ+ | + |
| L鏈蛋白 | k-λ- | k-λ- | K+或λ+ | K+或λ+ | + |
| Vpre-B/γ5蛋白 | + | + | ± | + | - |
| SIgM | - | - | + | + | - |
| SIgD | - | - | - | + | - |
| thy-1 | + | - | - | - | - |
| B220 | + | + | + | + | - |
| Tdt | + | - | - | - | - |
| mb-1(CD79a) | + | + | + | + | - |
| B29(CD79b) | - | + | + | + | - |
| CD19 | + | + | + | + | - |
| CD21 | - | + | + | + | - |
| PCA-1 | - | - | - | - | + |
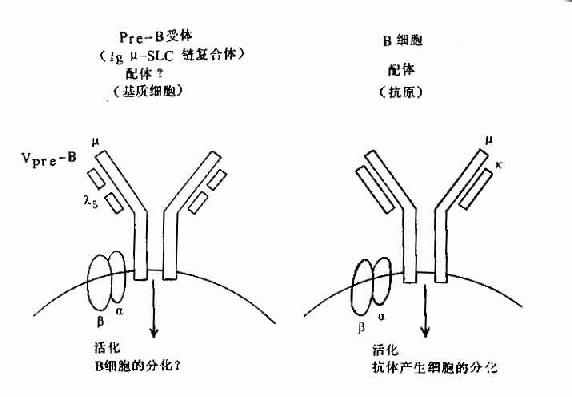
圖8-6 pre-B受體(μ-SLC)與B細胞抗原受體機能
1.祖B細胞 這種發育早期的B細胞,發生在人胚胎約第9周開始,小鼠約第14天開始。尚未表達B細胞系的特異表面標誌,也未發生lg基因重排,仍處於胚系基因(germline)階段。但祖B細胞的晚期可出現B系特異標誌,Thy-1+、Tdt+、B200+、mb-1+等分子。
2.前B細胞 是由祖B細胞分化而來,約佔成人骨髓有核細胞的5%。前B細胞能檢出的最早標誌是lg重鏈基因重排,隨後在胞漿中可檢測出IgM的重鏈分子,即μ鏈。但無輕鏈基因重排,因此也無膜Ig表達。
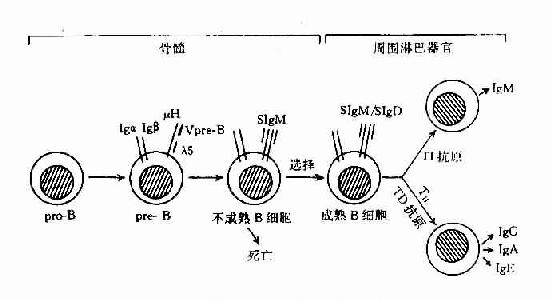
圖8-7 B細胞分化膜式圖
但近年在小鼠前B細胞株中,克隆出二個前B細胞特有的基因,並與Cγ與Vγ同源,分別命名為λ5和Vpre-B基因,在人也證明前B細胞中存在此種基因。它們編碼的蛋白Vpre-B和λ5可非共價結合,形成偽輕鏈(pseudo L chain,Фl)或替代輕鏈(surrogate L chain)。此偽L鏈可與μ鏈結合形成μ重鏈與偽L鏈複合體,並表達於前B細胞膜上構成其受體,與信號傳導有關,對前B細胞的進一步分化具有重要作用。
此階段還表達MHCⅡ、Tdt、CD19、CD10、CD20和CD24等分化抗原。其中CD19、CD20、和CD22在胞漿中的出現均早於μ鏈。前B細胞對抗原無應答能力,不表現免疫功能。
3.不成熟B細胞 此階段發生L鏈基因重排,故可組成完整的IgM分子,並表達於膜表面(IgM),可稱為Bμ細胞。此種細胞如與抗原結合,易使膜受體交聯,產生負信號,使B細胞處於受抑狀態,不能繼續分化為成熟B細胞。這種作用可能是使自身反應B細胞克隆發生流產,是形成B細胞自身耐受的機制之一。
不成熟B細胞開始喪失Tdt和CD10,但可表達CD22、CD21及FcR。同時CD19、CD20以及MHCⅡ類分子表達量增加。
4.成熟B細胞 隨著B細胞的進一步分化,可發育為成熟B細胞,並離開骨髓進入周圍免疫器官。此時膜表面可同時表達sIgM和sIgD,但其V區相同,而C區不同,故其識別抗原特異性是相同的。成熟B細胞可發生於一系列膜分子變化,可表達其它多種膜標誌分子,如絲裂原受體、補體受體、Fc受體、細胞因子受體,病毒受體以及一些其它分化抗原等。
5.漿細胞(PC) 成熟B細胞可在周圍淋巴器巴接受抗原刺激,在TH細胞及抗原呈遞細胞的協助下,及其產生的細胞因子作用下可使B細胞活化,增殖並分化為合成和分泌抗體的漿細胞。此階段B細胞可逐漸丟失一些膜分子如CD19和CD22等。並可發生Ig的類別轉換,從產生IgM轉換為產生Igg 、IgA或IgE的B細胞。
在此期分化過程中,有部分B細胞可恢復為小淋巴細胞,並停止增殖和分化,SIgD可消失,且壽命長,可生存數月至數年。當再次與同抗原相接觸時易於活化和分化,故稱此種細胞記憶B細胞,與機體的再次免疫應答相關。
當成熟B細胞分化為漿細胞時,B細胞表面的部分標誌消失,並出現一些新的漿細胞特有標誌,如漿細胞抗原-1(PCA-1)等分子。一種漿細胞只能產生一種類別的Ig分子,並且喪失產生其它類別的能力。漿細胞壽命長較短,其生存期僅數日,隨後即死亡。
| 關於「醫學免疫學/B細胞的發育」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |