膠體
| A+醫學百科 >> 膠體 |
膠體(英語:Colloid)又稱膠狀分散體(colloidal dispersion)是一種均勻混合物,在膠體中含有兩種不同狀態的物質,一種分散,另一種連續。分散的一部分是由微小的粒子或液滴所組成,分散質體子直徑在1nm—100nm之間的分散系;膠體是一種分散質體子直徑介於粗分散體系和溶液之間的一類分散體系,這是一種高度分散的多相不均勻體系。
目錄 |
分類
2、按分散質的不同可分為粒子膠體、分子膠體;
實例
1、煙,雲,霧是氣溶膠,煙水晶,有色玻璃、水晶是固溶膠,蛋白溶液,澱粉溶液是液溶膠;
2、澱粉膠體,蛋白質膠體是分子膠體,土壤是粒子膠體;
膠體的性質
能發生丁達爾現象,聚沉,產生電泳,可以滲析,吸附等性質
應用
1、農業生產:土壤的保肥作用.土壤里許多物質如粘土,腐殖質等常以膠體形式存在.
2、醫療衛生:血液透析,血清紙上電泳,利用電泳分離各種胺基酸和蛋白質.13。醫學上越來越多地利用高度分散的膠體來檢驗或治療疾病,如膠態磁流體治癌術是將磁性物質製成膠體粒子,作為藥物的載體,在磁場作用下將藥物送到病灶,從而提高療效。
3、日常生活:制豆腐原理(膠體的聚沉)和豆漿牛奶,粥,明礬淨水.
4、自然地理:江河人海口處形成三角洲,其形成原理是海水中的電解質使江河泥沙所形成膠體發生聚沉.
5、工業生產:制有色玻璃(固溶膠),冶金工業利用電泳原理選礦,原油脫水等.在金屬、陶瓷、聚合物等材料中加入固態膠體粒子,不僅可以改進材料的耐衝擊強度、耐斷裂強度、抗拉強度等機械性能,還可以改進材料的光學性質。有色玻璃就是由某些膠態金屬氧化物分散於玻璃中製成的。國防工業中有些火藥、炸藥須製成膠體。一些奈米材料的製備,冶金工業中的選礦,是有原油的脫水,塑料、橡膠及合成纖維等的製造過程都會用到膠體。
膠體淨水的原理
膠體粒子的直徑一般在1nm——100nm之間,它決定了膠體粒子具有巨大的表面積,吸附力很強,能在水中吸附懸浮固體或色素形成沉澱,從而使水淨化,這就是膠體淨水的原理。
能在水中自然形成濃度較大的膠體,並且對水質無明顯副作用的物質有KAl(SO4).12H2O、FeCl3.6H2O等,這樣的物質被稱為淨水劑,其形成膠體的化學原理是使其發生水解反應:
Fe3+ + 3H2O==(可逆號) Fe(OH)3(膠體)+3H+
Al3+ + 3H2O==(可逆號)Al(OH)3(膠體)+3H+
具體介紹
為了回答什麼是膠體這一問題,我們做如下實驗:將一把泥土放到水中,大粒的泥沙很快下沉,渾濁的細小土粒因受重力的影響最後也沉降於容器底部,而土中的鹽類則溶解成真溶液.但是,混雜在真溶液中還有一些極為微小的土壤粒子,它們既不下沉,也不溶解,人們把這些即使在顯微鏡下也觀察不到的微小顆粒稱為膠體顆粒,含有膠體顆粒的體系稱為膠體體系.膠體化學,狹義的說,就是研究這些微小顆粒分散體系的科學.
通常規定膠體顆粒的大小為1~100nm(按膠體顆粒的直徑計).小於1nm的幾顆粒為分子或離子分散體系,大於100nm的為粗分散體系.既然膠體體系的重要特徵之一是以分散相粒子的大小為依據的,顯然,只要不同聚集態分散相的顆粒大小在1~100nm之間,則在不同狀態的分散介質中均可形成膠體體系.例如,除了分散相與分散介質都是氣體而不能形成膠體體系外,其餘的8種分散體系均可形成膠體體系.
習慣上,把分散介質為液體的膠體體系稱為液溶膠,如介質為水的稱為水溶膠;介質為固態時,稱為固溶膠.
由此可見,膠體體系是多種多樣的.溶膠是物質存在的一種特殊狀態,而不是一種特殊物質,不是物質的本性.任何一種物質在一定條件下可以晶體的形態存在,而在另一種條件下卻可以膠體的形態存在.例如,氯化鈉是典型的晶體,它在水中溶解成為真溶液,若用適當的方法使其分散於苯或醚中,則形成膠體溶液.同樣,硫磺分散在乙醇中為真溶液,若分散在水中則為硫磺水溶膠.
由於膠體體系首先是以分散相顆粒有一定的大小為其特徵的,故膠粒本身與分散介質之間必有一明顯的物理分界面.這意味著膠體體系必然是兩相或多相的不均勻分散體系.
另外,有一大類物質(纖維素、蛋白質、橡膠以及許多合成高聚物)在適當的溶劑中溶解雖可形成真溶液,但它們的分子量很大(常在1萬或幾十萬以上,故稱為高分子物質),因此表現出的許多性質(如溶液的依數性、黏度、電導等)與低分子真溶液有所不同,而在某些方面(如分子大小)卻有類似於溶膠的性質,所以在歷史上高分子溶液一直被納入膠體化學進行討論。30多年來,由於科學迅速地發展,它實際上已成為一個的科學分支——高分子物理化學,所以近年來在膠體表面專著(特別是有關刊物)中,一般不再過多地討論這方面內容。
——摘自《膠體與表面化學(第三版)》,化學化工出版社
膠體
定義
分散質體子大小在1nm~100nm的分散系。
膠體與溶液、濁液在性質上有顯著差異的根本原因是分散質體子的大小不同。
常見的膠體
Fe(OH)3膠體、Al(OH)3膠體、矽酸膠體、澱粉膠體、蛋白質、血液、豆漿、墨水、塗料、肥皂水、AgI、Ag2S、As2S3
分類
按照分散劑狀態不同分為:
氣溶膠——分散質、分散劑都是氣態物質:如SO2擴散在空氣中
液溶膠——分散質、分散劑都是液態物質:如Fe(OH)3膠體
固溶膠——分散質、分散劑都是固態物質:如有色玻璃、煙水晶
區分膠體與溶液的一種常用物理方法
利用丁達爾效應
膠體粒子對光線散射而形成光亮的「通路」的現象,叫做丁達爾現象。
膠粒帶有電荷
膠粒具有很大的比表面積(比表面積=表面積/顆粒體積),因而有很強的吸附能力,使膠粒表面吸附溶液中的離子。這樣膠粒就帶有電荷。不同的膠粒吸附不同電荷的離子。一般說,金屬氫氧化物、金屬氧化物的膠粒吸附陽離子,膠粒帶正電,非金屬氧化物、金屬硫化物的膠粒吸引陰離子,膠粒帶負電。
膠粒帶有相同的電荷,互相排斥,所以膠粒不容易聚集,這是膠體保持穩定的重要原因。
由於膠粒帶有電荷,所以在外加電場的作用下,膠粒就會向某一極(陰極或陽極)作定向移動,這種運動現象叫電泳。
膠體的種類很多,按分散劑狀態的不同可分為液溶膠、氣溶膠和固溶膠。如:雲、煙為氣溶膠,有色玻璃為固溶膠。中學研究的膠體一般指的是液溶膠。膠體的性質體現在以下幾方面:
①有丁達爾效應
當一束光通過膠體時,從入射光的垂直方向上可看到有一條光帶,這個現象叫丁達爾現象。利用此性質可鑒別膠體與溶液、濁液。
②有電泳現象
由於膠體微粒表面積大,能吸附帶電荷的離子,使膠粒帶電。當在電場作用下,膠體微粒可向某一極定向移動。
利用此性質可進行膠體提純。
膠粒帶電情況:金屬氫氧化物、金屬氧化物和AgI的膠粒一般帶正電荷,而金屬硫化物和矽酸的膠粒一般帶負電荷。
③可發生凝聚
加入電解質或加入帶相反電荷的溶膠或加熱均可使膠體發生凝聚。加入電解質中和了膠粒所帶的電荷,使膠粒形成大顆粒而沉澱。一般規律是電解質離子電荷數越高,使膠體凝聚的能力越強。用膠體凝聚的性質可制生活必需品。如用豆漿制豆腐,從脂肪水解的產物中得到肥皂等。
④發生布朗運動
含義:無規則運動(離子或分子無規則運動的外在體現)
產生原因:布朗運動是分子無規則運動的結果
布朗運動是膠體穩定的一個原因
膠體的知識與人類生活有著極其密切的聯繫。除以上例子外還如:
①土壤里發生的化學過程。因土壤里許多物質如粘土、腐殖質等常以膠體形式存在。
②國防工業的火藥、炸藥常製成膠體。
③石油原油的脫水、工業廢水的淨化、建築材料中的水泥的硬化,都用到膠體的知識。
④食品工業中牛奶、豆漿、粥都與膠體有關。
總之,人類不可缺少的衣食住行無一不與膠體有關,膠體化學已成為一門獨立的學科。
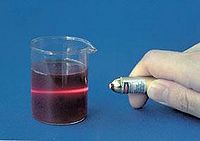
Fe(OH)3膠體製備:將25毫升的蒸餾水加熱至沸騰,再逐滴加入1-2毫升的飽和氯化鐵溶液,繼續煮沸至溶液呈紅褐色。
相關化學式:FeCl3 +3H20 = Fe(OH)3(膠體)+3HCl
相關離子式:Al3+ +3H2o=Al(OH)3(膠體)+3H+
膠體電性
(1)正電:
一般來說,金屬氫氧化物、金屬氧化物的膠體粒子帶正電荷,如Fe(OH)3 , Al(OH)3 , Cr(OH)3 , H2TiO3 , Fe2O3 , ZrO2 , Th2O3
(2)負電:
非金屬氧化物、金屬硫化物的膠體粒子帶負電荷,如As2S3 , Sb2S3 , As2O3 , H2SiO3 , Au , Ag , Pt
(3)膠體粒子可以帶電荷,但整個膠體呈電中性
膠體的製備
A物理法:如研磨(制豆漿,研墨),直接分散(制蛋白質膠體)
B水解法:
如向煮沸的蒸餾水滴加FeCl3飽和溶液,得紅褐色Fe(OH)3膠體(此法適用於制金屬氫氧化物膠體)
1.不可過度加熱,否則膠體發生聚沉,生成Fe(OH)3沉澱
2.不可用自來水,自來水中有電解質會使膠體發生聚沉,應用蒸餾水
3.複分解+劇烈震蕩法
4.FeCl3不能過量,過量的FeCl3也能使膠體發生聚沉
5.書寫製備膠體的化學方程式時,生成的膠體不加沉澱符號「↓」
膠體與溶液的分離
滲析法。
滲析又稱透析。利用半透膜能透過小分子和小離子但不能透過膠體粒子的性質從溶膠中除掉作為雜質的小分子或離子的過程。
滲析時將膠體溶液置於由半透膜構成的滲析器內,器外則定期更換膠體溶液的分散介質(通常是水),即可達到純化膠體的目的。滲析時外加直流電場常常可以加速小離子自膜內向膜外的擴散,為電滲析(electrodialysis)。
利用半透膜的選擇透過性分離不同溶質的粒子的方法。在電場作用下進行溶液中帶電溶質體子(如離子、膠體粒子等)的滲析稱為電滲析。電滲析廣泛應用於化工、輕工、冶金、造紙、海水淡化、環境保護等領域;近年來更推廣應用於胺基酸、蛋白質、血清等生物製品的提純和研究。電滲析器種類較多,W.鮑里的三室型具有代表性,其構造見圖。電滲析器由陽極室、中間室及陰極室三室組成,中間DD為封接良好的半透膜,E為Pt、Ag、Cu等片狀或棒狀電極,F為連接中間室的玻璃管,作洗滌用,S為pH計。電滲析實質上是除鹽技術。電滲析器中正、負離子交換膜具有選擇透過性,器內放入含鹽溶液,在直流電的作用下,正、負離子透過膜分別向陰、陽極遷移。最後在兩個膜之間的中間室內,鹽的濃度降低,陰、陽極室內為濃縮室。電滲析方法可以對電解質溶質或某些物質進行淡化、濃縮、分離或製備某些電解產品。實際應用時,通常用上百對以上交換膜,以提高分離效率。電滲析過程中,離子交換膜透過性、離子濃差擴散、水的透過、極化電離等因素都會影響分離效率。
膠體粒子的結構
根據Fajans規則,膠體粒子是膠團,它又包括膠粒與擴散層,而膠粒有包括膠核與吸附層。以製備AgI為例,當AgNO3過量時,結構可表示為
| 關於「膠體」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |