醫用化學/沉澱的生成和溶解
| 醫學電子書 >> 《醫用化學》 >> 電解質溶液 >> 沉澱-溶解平衡 >> 沉澱的生成和溶解 |
| 醫用化學 |
|
|
|
在某微溶電解質溶液中,各有關離子濃度冪之乘積稱為離子積。對於MmAa微溶電解質來說,溶液中[M]m[A]n稱為它的離子積它可以是任意數值,不是常數,因為並未註明是飽和溶液。離子積和溶度積兩者的概念是有區別的。①當溶液中[M]m[A]n<Ksp時,是未飽和溶液,如果體系中有固體存在,將繼續溶解,直至飽和為止;②當[M]m[A]n = Ksp時,是飽和溶液,達到動態平衡;③當[M]m[A] n>Ksp時,將會有MmAn沉澱析出,直至成為飽和溶液。以上三點稱為溶度積規則,它是微溶電解質多相離子平衡移動規律的總結。根據溶度積規則可以控制離子濃度,使沉澱生成或溶解。
(一)沉澱的生成
根據溶度積的規則,在微溶電解質溶液中,如果離子積大於溶度積常數Ksp,就會有沉澱生成。因此,要使溶液析出沉澱或要使沉澱得更完全,就必須創造條件,使其離子積大於溶度積。
例9 AgCL的Ksp=1.80×10-10,將0.001 mol.L-1NaCL和0.001 mol.L-1AgNO3溶液等體積混合,是否有AgCl 沉澱生成.
解: 兩溶液等體積混合後, Ag+ 和CL-濃度都減小到原濃度的1/2.
[Ag+]=[CL-]=1/2×0.001=0.005(mol.L-1)
在混合溶液中,則[Ag+][CL-]=(0.005)2=2.5×10-7
因為[Ag+][CL-]>Ksp,所以有AgCl 沉澱生成.
例10 在0.1mol.L-1KCL和0.1 mol.L-1K2CrO4混合溶液中,逐滴加入AgNO3溶液,問AgCL和AgCrO4兩種微溶電解質,哪個最先產生沉澱?
解:設混合液中產生AgCL沉澱時,所需[Ag+]為x mol.L-1,而產生Ag2CrO4沉澱時,所需[Ag+]為y mol.L-1;已知AgCL的Ksp=1.80×10-10,Ag2CrO4的Ksp=1.1×10-12.
根據溶度積常數表達式,則
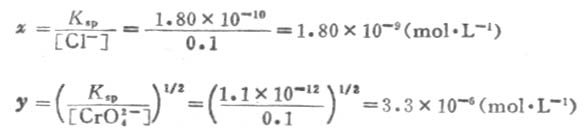
因為x《y ,就是說產生AgCL沉澱時所需Ag+的濃度遠小於產生AgCrO4沉澱時所需Ag+的濃度。所以,在混合溶液中,逐滴加入AgNO3溶液時,最先析出AgCL白色沉澱;只有溶液中[Ag+]達到3.3×10-6mol.L-1以上時,才能析出Ag2CrO4磚紅色沉澱。
由此可見,溶液中有兩種以上都能與同種離子反應產生沉澱的離子時,最先析出的是溶解度較小的化合物,這就是分步沉澱。
例11 BaSO4在水中的溶解度是1.05×10-5 mol.L-1,問在0.01 mol.L-1Na2SO4溶液中BaSO4的溶解度是多少?
解: BaSO4的Ksp=1.1×10-10,BaSO4在溶液中的離解平衡:
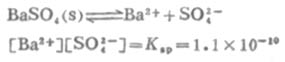
設在0.01 mol.L-1Na2SO4溶液中BaSO4的溶解度為x mol.L-1,則[Ba2+]=x mol.L-1,[SO2-4]=(0.01+x) mol.L-1因為x值遠小於0.01,可以忽略不計,則(0.01+x)≈0.01,所以
x×0.01=1.1×10-10
x=1.1×10-8
由此可見,在微溶電解質飽和溶液中,加入含有相同離子的強電解質時,將使微溶電解質的溶解度降低,這就是前面所講到的同離子效應.所以,加入適當過量的沉澱劑,可以使沉澱更趨完全,達到我們所要求的目的.
(二)沉澱的溶解
根據溶度積原理,沉澱溶解的必要條件是溶液中離子積小於溶度積Ksp因此,創造一定條件,降低溶液中的離子濃度,使離子積小於其溶度積,就可使沉澱溶解.
使沉澱溶解的常用方法主要有三種:
大多數微溶氫氧化物都能溶於強酸.例如Fe(OH)3能溶於鹽酸.反應如下:
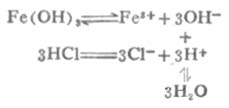
由於溶液中生成了弱電解質H2O,使[OH]-減小,溶液中[Fe3+][OH-]3<Fe(OH)3的Ksp,使平衡向Fe(OH)3溶解的方向移動,即向右移動.若有足量鹽酸,沉澱可以完全溶解.
少數微溶氫氧化物能溶於銨鹽.例如Mg(OH)2溶於銨鹽的反應如下:
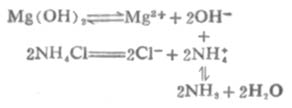
由於溶液中生成了弱電解質NH3和H2O,使[OH-]減小,溶液中[Mg2+][OH-]2<Mg(OH)2的Ksp,使平衡向Mg(OH)2溶解的方向移動。若有足量銨鹽,沉澱可以完全溶解。
大多數微溶弱酸鹽都能溶於強酸,例如CaCO3能溶於鹽酸。反應如下:
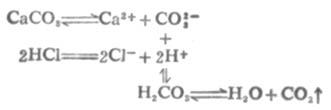
由於溶液中生成了弱電解質H2CO3,H2CO3不穩定,分解成H2O和CO2,CO2從溶液中逸出,使[CO2-3]減小。所以溶液中[Ca2+][CO2-3]<CaCO3的Ksp,平衡向CaCO3溶解的方向移動。若有足量鹽酸,沉澱可以完全溶解。
2.加入適當氧化劑或還原劑,與溶液中某種離子發生氧化-還原反應。 例如,在CuS沉澱中加入稀HNO3,因為S2-被氧化成單質硫,從而使溶液中[S2-]減小,所以溶液中[Cu2+][S2-]<CuS的Ksp,使CuS沉澱逐步溶解。反應如下:
3CuS+8HNO3=3Cu(NOa)2+2NO↑+4H2O+3S↓
3.加入適當試劑,與溶液中某種離子結合生成配合物。
例如,AgCL沉澱能溶於氨水。反應如下:
由於生成了穩定的[Ag(NH3)2]+,大大降低了Ag+的濃度,所以AgCL沉澱溶解。
應當指出,在含有沉澱的溶液中,加入適當試劑與溶液中某種離子結合生成更難溶解於水的物質,這叫做沉澱轉化。例如,在PbCL2沉澱中,加入Na2CO3溶液後,又生成了一種新的沉澱PbCO3。反應如下:
![]()
由於反應生成了更難溶解的PbCO3沉澱,降低了溶液中[Pb2+],使平衡向生成PbCO3沉澱的方向移動,所以PbCL2沉澱溶解。
由此可見,在有微溶電解質固體存在的溶液中,只要有關離子積小於Ksp,這種微溶電解質就能溶解。因此,在實際工作中,常在有微溶電解質固體存在的溶液中加入某種物質,如能與微溶電解質的離子反應,生成弱電解質、配合物、更難溶解垢物質或可以發生氧化還原反應,從而破壞了沉澱與離子間的平衡,可以促進微溶電解質的溶解或轉化。
| 關於「醫用化學/沉澱的生成和溶解」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |