醫用化學/碳原子的sp3、sp2和sp雜化軌道
| 醫學電子書 >> 《醫用化學》 >> 有機化合物概述 >> 碳原子的sp3、sp2和sp雜化軌道 |
| 醫用化學 |
|
|
|
雜化軌道理論已在第四章 討論過了。本節僅對碳原子的雜化軌道作一簡單介紹。
甲烴分子中的碳原子是sp3雜化的,雜化後的四個sp3軌道構成109°28′的夾角[圖10-1(a)]。在甲烷分子中,碳原子的四個sp3雜化軌道分別與四個氫原子1s軌道重疊形成鍵角為109°28′的正四面體分子[圖10-1(b)]。
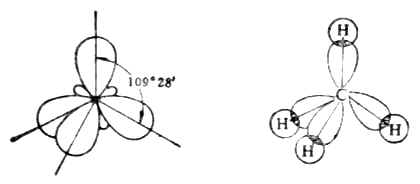
(a) (b)
圖10-1 四個sp3雜化軌道和甲烷
成鍵情況
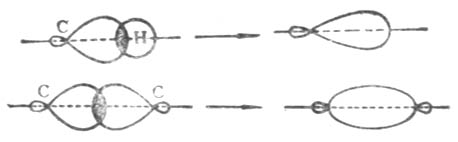
圖10-2 由sp3-s和sp3-sp3形成的碳氫o鍵和碳碳o鍵
烷烴分子中的碳氫鍵和碳碳鍵是碳原子的一個sp3雜化軌道與氫原子的1s軌道或另一個碳原子的一個sp3雜化軌道重疊而成(圖10-2)。這樣形成的碳氫單鍵和碳碳單鍵,其電子云具有圓柱狀的軸對稱,叫做σ鍵。由於它是軸對稱的,所以用單鍵相連的碳氫原子或碳碳原子可以圍繞軸自由旋轉。
乙烯分子中的碳原子與甲烷的碳原子不同,它是sp2雜化的。也就是說,碳原子的三個p軌道中的兩個參與雜化,而另一個p軌道未參與雜化。雜化後生成了三個相同的sp2軌道。這三個軌道軸在同一個平面上,互成120°的角。另一個未參與雜化的p軌道的對稱軸垂直於這個平面。
在乙烯分子中,碳原子的三個sp2雜化軌道中的兩個同氫原子的1s軌道重疊形成碳氫σ鍵。未參與雜化的兩個p軌道用側面互相重疊形成一個π鍵(圖10-3)。
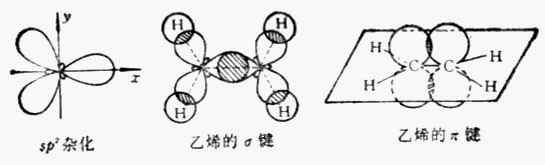
圖10-3 sp雜化軌道及乙烯的o鍵和π鍵
所以,雙鍵是由一個σ鍵和一個π鍵組成的。
碳原子的2s軌道同一個2p軌道雜化,形成兩個相同的sp雜化軌道。它們對稱地分布在碳原子的兩側,二者之間的夾角為180°。乙炔分子中的鍵就是由sp雜化軌道形成的。碳原子的一個sp雜化軌道同氫原子的1s軌道形成碳氫σ鍵,另一個sp雜化軌道與相鄰的碳原子的sp雜化軌道形成碳碳σ鍵,組成直線結構的乙炔分子。沒有參與雜化的兩個p軌道與另一個碳的兩個p軌道相互平行,且「肩並肩」地重疊,形成兩個相互垂直的π鍵(圖10-4)。
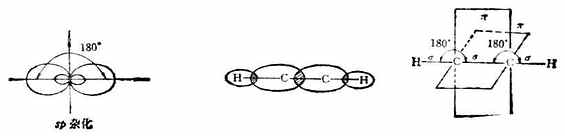
圖10-4 sp雜化軌道及乙炔的o鍵和π鍵
| 關於「醫用化學/碳原子的sp3、sp2和sp雜化軌道」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |