醫用化學/共軛酸鹼的強弱
| 醫學電子書 >> 《醫用化學》 >> 電解質溶液 >> 酸鹼質子理論 >> 共軛酸鹼的強弱 |
| 醫用化學 |
|
|
共軛酸鹼對的離解常數Ka和Kb之間有確定的關係。以HOAc為例推導如下:
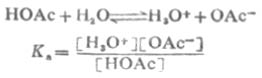
由於溶劑水的濃度不常數,所以它不出現在平衡常數式中。
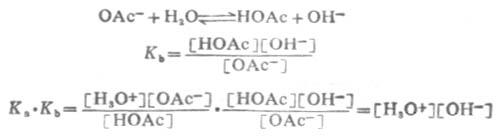
用KW表示[H3O+][OH-],KW稱為水的離子積。這說明在一定溫度下,水中的[H3O+]與[OH-]的乘積為一常數。所以 Ka.Kb=KW (2-7)
24℃時KW值為1.0×10-14.這個關係說明,只知道了酸的離解常數Ka,就可以計算出它的共軛鹼的Kb,反之亦然。Ka和Kb是成反比的,而Ka和Kb正是反映酸和鹼的強度,所以,在共軛酸鹼對中,酸的強度愈大,其共軛鹼的強度愈小;鹼的強度愈大,其共軛酸的強度愈小。表2-6列出了一些共軛厔鹼對的強度次序。
表2-6 共軛酸鹼的強度次序
| 酸性增強 | 共軛酸(HB) | Ka(在水中) | pKa(在水中) | 共軛鹼(B) |
鹼性增強 |
| H3O+ | H2O | ||||
| H2C2O4 | 5.4×10-2 | 1.27 | HC2O-4 | ||
| H2SO3 | 1.54×10 | 1.81 | HSO-3 | ||
| HSO-4 | 1.20×10-2 | 1.92 | SO2-4 | ||
| H3PO4 | 7.51×10-3 | 2.12 | H2PO-4 | ||
| HNO2 | 4.6×10-4 | 3.37 | NO-2 | ||
| HF | 3.53×10-4 | 3.45 | F- | ||
| HCOOH | 1.77×10-4 | 3.75 | HCOO- | ||
| HC2O-4 | 5.4×10-5 | 4.27 | C2O2-4 | ||
| CH3COOH | 1.76×10-5 | 4.75 | CH3COO- | ||
| H2CO3 | 4.30×10-7 | 6.37 | HCO-3 | ||
| HSO-3 | 1.02×10-7 | 6.91 | SO2-3 | ||
| H2S | 9.1×10-8 | 7.04 | HS- | ||
| H2PO-4 | 6.23×10-8 | 7.21 | HPO2-4 | ||
| NH+4 | 5.68×10-10 | 9.25 | NH3 | ||
| HCN | 4.93×10-10 | 9.31 | CH- | ||
| HCO-3 | 5.61×1011 | 10.25 | CO2-3 | ||
| H2O2 | 2.4×10-12 | 11.62 | HO-2 | ||
| HS- | 1.1×10-12 | 11.96 | S2- | ||
| HPO2-4 | 2.2×10-13 | 12.67 | PO3-4 | ||
| H2O | OH- |
根據酸鹼質子理論,酸鹼在溶液中所表現出來的強度,不僅與酸鹼的本性有關,也與溶劑的本性有關。我們所能測定的是酸鹼在一定溶劑中表現出來的相對強度。同一種酸或鹼,如果溶於不同的溶劑,它們所表現的相對強度就不同。例如HOAc在水中表現為弱酸,但在液氨中表現為強酸,這是因為液氨奪取質子的能力(即鹼性)比水要強得多。這種現象進一步說明了酸鹼強度的相對性。
出自A+醫學百科 「醫用化學/共軛酸鹼的強弱」條目 http://cht.a-hospital.com/w/%E5%8C%BB%E7%94%A8%E5%8C%96%E5%AD%A6/%E5%85%B1%E8%BD%AD%E9%85%B8%E7%A2%B1%E7%9A%84%E5%BC%BA%E5%BC%B1 轉載請保留此連結
| 關於「醫用化學/共軛酸鹼的強弱」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |