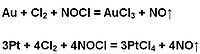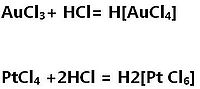王水
| A+醫學百科 >> 王水 |
王水(aqua regia) 又稱「王酸」「硝基鹽酸」,是一種腐蝕性非常強、冒黃色煙的液體,是濃鹽酸(HCl)和濃硝酸(HNO3)組成的混合物,其混合比例從名字中就能看出:王,三橫一豎,故鹽酸與硝酸的體積比為3:1。它是少數幾種能夠溶解金(Au)物質之一,這也是它名字的來源。王水一般用在蝕刻工藝和一些檢測分析過程中,不過塑料之王——聚四氟乙烯和一些非常惰性的純金屬如鉭(Ta)不受王水腐蝕(還有氯化銀和硫酸鋇等)。王水極易分解,有氯氣的氣味,因此必須現配現用。
目錄 |
一、歷史
有兩位科學家,勞厄和弗蘭克,曾獲得1914年和1925年的物理學獎,德國納粹政府要沒收他們的諾貝爾獎牌,他們輾轉來到丹麥,請求丹麥同行、1922年物理學獎得主玻爾幫忙保存。1940年,納粹德國佔領丹麥,受人之託的玻爾急得團團轉。同在實驗室工作的一位匈牙利化學家赫維西(1943年化學獎得主)幫他想了個好主意:將獎牌放入「王水」(鹽酸與硝酸混合液)中,純金獎牌便溶解了。玻爾於是將溶液瓶放在實驗室架子上,來搜查的納粹士兵果然沒有發現這一秘密。戰爭結束後,溶液瓶里的黃金被還原後送到斯德哥爾摩,按當年的模子重新鑄造,於1949年完璧歸趙時,當時弗蘭克工作的美國芝加哥市還專門舉行了一個隆重的獎牌歸還儀式。
二、原理
雖然王水的兩個組成部分單一無法溶解金,但它們聯合起來卻可以溶解金,原理是這樣的:硝酸是一種非常強烈的氧化劑,它可以溶解極微量的金,而鹽酸則可以與溶液中的金離子反應,形成四氯合金酸(鉑是生成了六氯合鉑酸,簡稱氯鉑酸),使金離子在氯離子的配位作用下減少,降低了金離子的電勢,這樣硝酸就可以進一步溶解金了。其實不是增強了硝酸氧化性,而是濃鹽酸增強了金鉑的還原性。
三、配法
取一體積濃硝酸慢慢倒入到三體積濃鹽酸中,不斷用玻棒攪拌.看到溶液迅速變黃這是由於生成亞硝醯氯之故.容器壁微熱 .沒有過什麼樣的劇烈反應!
王水:需現配現用,王水可用來溶解許多金屬和合金,其中包括鋼、高溫合金鋼、鋁合金、銻、鉻和鉑族金屬等。王水和其他類似混合液在化學分析中用於溶解某些鐵礦石、磷酸鹽岩石、礦渣、鎳鉻合金、銻和硒以及不易溶解的汞、砷、鈷和鉛的硫化物。
植物體與廢水也常使用它來進行消化。王水可從矽酸鹽基質中酸洗出部分金屬,但無法有效的加以完全溶解。
逆王水:也叫勒福特王水(Lefort),是三份硝酸與一份鹽酸的混合物,可用來溶解氧化硫和黃鐵礦。 危險,注意安全使用!!!!!
王水中含有硝酸、氯氣和氯化亞硝醯等一系列強氧化劑,同時還有高濃度的氯離子,王水的氧化能力比硝酸強,一些不溶於硝酸的金屬如金、鉑等能被王水溶解,王水因此被稱為「水」中之王。王水溶解金和鉑的反應方程式如下: Au+HNO3+4HCl=H[AuCl4]+NO+2H2O
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO+8H2O
最常見和為人熟知的王水為硝酸和鹽酸的混合液,但是其中的氧化劑HNO3可以用其他氧化性強酸所代替。
王水的配合是很巧妙的,3個條件:
一:
兩種強酸。
二:
其中一種是配合性強的酸,保證大量的Cl-(Cl-一定的絡合性),F-雖然表現為更強的金屬配合性,但是HF在水中難以完全電離,難以保證大量F-的存在;Br-太容易被氧化,難以保證整個溶液強有力的氧化性。所以必須用鹽酸。
三:
另一種酸氧化性必須適中,要足夠強,但是不能太強,太強,把Cl-(氯離子)大量氧化了就喪失了第二個條件,而濃硝酸剛好是常見酸中滿足這個條件的。
這兩種最常見的酸配伍可以說是天作之合。但是其實硝酸其實可以用別的酸代替,比如硒酸(H2SeO4),但是並不常見,但是卻和王水有一樣的效用,好處是還原產物(H2SeO3或者SeO2)不是氣體,不會造成氣體中毒,反應產物全部在溶液中。
四、王水及其氧化作用
王水是由1體積的濃硝酸和3體積的濃鹽酸混合而成的(嚴格地說是在製取混酸所用的溶質HNO3和HCl的物質的量之比為1∶3)。王水的氧化能力極強,曾被認為是酸中之王(直到超強酸的發現,才知道王水是小巫見大巫)。一些不溶於硝酸的金屬,如金、鉑等都可以被王水溶解(鉑必須被加熱才能緩慢反應)。
(鉑金反應很慢基本肉眼難以觀察到)
高濃度的氯離子與其金屬離子可形成穩定的絡離子,如[AuCl4]-:
(理論上的化學式)
從而使金的標準電極電位減小,有利於反應向金屬溶解的方向進行。總反應的化學方程式可表示為:
(其中鉑金反應尚待研究)
由於金和鉑能溶解於王水中,人們的金鉑首飾(黃金)在被首飾加工商加工清洗時,常會在不知不覺中被加工商用這種方法偷取,損害消費者的利益。
王水能夠溶解金和鉑的原因,過去曾被認為是在王水中產生了原子氯和強氧化性的氯化亞硝基的緣故:
HNO3+3HCl=NOCl+Cl2+2H2O
現在看來,主要是由於大量氯離子的存在,能夠形成配位離子,從而改變了電極電勢的結果。以金為例:
Au與Cl配位形成AuCl4
+ 3e = Au; E = 1.52V AuCl4 + 3e = Au + 4Cl; E = 1.002V 可以看出,在沒有氯離子存在下,硝酸和氯都不易氧化金,但是當金在氯離子存在下時,它的電極電勢降低很多,換句話講,由於形成AuCl4而增強了金的還原能力。這時氯甚至濃硝酸也能氧化Au成AuCl4。所以,王水能溶解金的主要原因不是王水的氧化能力被增強,而是金屬的還原能力被增強。
五、中科院院士、空間物理學家
王水院士,1942年4月出生,1961年畢業於南京大學,分配到中國科學技術大學任教至今。
1978年評為副教授,1985年晉陞教授。
1986年被批准為博士生導師。
1993年當選為中國科學院院士。現任中國地球物理學會理事長,中國空間科學學會常務理事,國際科聯(ICSU)日地物理科學委員會(SCOSTEP)學科代表。
主要從事空間物理領域研究。
20世紀70年代,與合作者率先在我國開展哨聲和甚低頻發射的觀測和研究,提出了低緯導管哨聲的觀測證據。
80年代與合作者發展了球坐標中的Euler全隱式計算格式和多維時變流動的近特徵邊界條件,對日冕擾動傳播等太陽大氣動力學現象開展了系統的磁流體力學數值研究。
80年代末,與合作者研究了具有超Alfven速流動電流片的穩定性,討論了其物理性質及其非線性演化。
90年代與合作者研究了日冕電流片中的磁場重聯過程,並出版了專著《磁場重聯》
。
21世紀與合作者開展了空間電漿體物理的理論研究,通過全粒子數值模擬發現無碰撞磁場重聯可以激發哨聲波。
已發表論文160餘篇,培養了20多名博士生和碩士生,曾獲得1993年國家自然科學二等獎、多項中國科學院自然科學獎及2000年何梁何利科學技術進步獎。
| 關於「王水」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |