拉烏爾定律
| A+醫學百科 >> 拉烏爾定律 |
拉烏爾定律(Raoult's law):物理化學的基本定律之一,是
法國物理學家F.-M.拉烏爾在1887年研究含有非揮發性溶質的稀溶液的行為時發現的,可表述為:「在某一溫度下,稀溶液的蒸氣壓等於純溶劑的蒸氣壓乘以溶劑的摩爾分數」。
其數學表達式為:
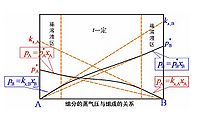
pA=p xA式中pA是溶液中溶劑的蒸氣分壓;p是純溶劑的蒸氣壓;xA是溶劑的物質的
量分數。
該定律是法國物理學家F.M.拉烏爾於1887年在實驗基礎上提出的,它是稀薄溶液的基本規律之一。對於不同的溶液,雖然定律適用的濃度範圍不同,但在xA→1的條件下任何溶液都能嚴格遵從上式。拉烏爾定律最初是在研究不揮發性非電解質的稀薄溶液時總結出來的,後來發現,對於其他稀薄溶液中的溶劑也是正確的。在任意滿足xA→1的溶液中,溶劑分子所受的作用力幾乎與純溶劑中的分子相同。所以,在一個溶液中,若其中某組分的分子所受的作用與純態時相等,則該組分的蒸氣壓就服從拉烏爾定律。
拉烏爾定律是溶液熱力學研究的基礎,它對相平衡和溶液熱力學函數的研究起指導作用。
在非電解質的稀溶液中,溶劑的蒸氣壓P,等於純溶劑的蒸氣壓P0與該溶液中所含溶劑
的克分子分數N0(溶劑克分子數與溶劑及溶質總克分子數的比數)的乘積:P=P0×N0。
是法國人拉烏爾在1880年所提出的。應用於蒸餾和吸收等過程的計算中。
出自A+醫學百科 「拉烏爾定律」條目 http://cht.a-hospital.com/w/%E6%8B%89%E4%B9%8C%E5%B0%94%E5%AE%9A%E5%BE%8B 轉載請保留此連結
| 關於「拉烏爾定律」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |