醫用化學/比色分析應用示例——鐵的含量測定
| 醫學電子書 >> 《醫用化學》 >> 比色分析 >> 比色分析應用示例——鐵的含量測定 |
| 醫用化學 |
|
|
|
一、原理
應用比色分析測定溶液中伯的含量有硫氰酸鹽顯色法、磺基水楊酸法及鄰菲羅啉顯色法等各各種方法。現以磺基水楊酸法為例介紹鐵的含量測定。
在不同酸度下,Fe3+和磺基水楊酸生成組成不同的配合物。若控制溶液PH值在8-11.5的條件下顯色,可生成配位數為6的黃色三磺基水楊酸合鐵配合物。反應式如:
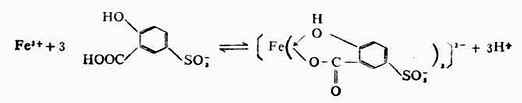
上式可簡寫為
![]()
溶液的最大吸收波長λmax=420nm,因此可在420nm 處進行測定(若用光電比色計測定可選擇藍色光片)。此方法適合於測定無大量Cu2+、Ca2+、Cr3+、Ni2+電漿存在的溶液中鐵離子的含量。
二、操作步驟
(一)標準曲線的繪製
稱取一定量硫酸鐵銨[NH4Fe(SO4)2.12H2O]用蒸餾水溶解,加適量配製成含 Fe3+0.1lg.L-1的標準溶液,再稀釋成含Fe3+0.025mg.L-1的操作溶液。
取25ml容量瓶6隻,編號後分別加入操作溶液0.00,1.00,2.00,3.00,4.00及5.00ml,各加入10%NH4CL溶液2ml和10%磺基水楊酸溶液2ml,滴加氨水至溶液由紫紅色變為黃色,並使氨水稍過量,然後用NH4CL-NH3緩衝溶液稀釋至刻度,搖勻,以1號為空白,在420nm處依次測定吸光度。以Fe3+含量為橫坐標,吸光度為縱坐標繪製標準曲線。
(二)樣品的測定
取25ml容量瓶1隻,準確加入經過處理的濃度在標準範圍內的被測溶液,按上面標準系列配製的同樣加入等量的顯色劑和緩衝溶液,在相同條件下測定被測溶液的吸光試,利用標準曲線找出樣品溶液的濃度,根據樣品溶液的稀釋倍數,求出樣品的含量。
例如,用磺基水劣根性酸法比色測定微量鐵含量。稱取0.432g硫酸鐵銨溶於水,加18%硫酸溶液1ml,轉移至500ml容量瓶中,用水定容,作為標準溶液,其濃度為0.1g.L-1。取下列不同體積的上述溶液於50ml容量瓶中,加入顯色劑後定容,在420nm處測定吸光度,結果如下:
| 溶液體積/ml | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| 吸光度A | 0.097 | 0.200 | 0.304 | 0.408 | 0.510 |
| c/(g.L-1)×103 | 2.00 | 4.00 | 6.00 | 8.00 | 10.00 |
以吸光度A值為縱坐標,標準溶液中Fe3+含量為縱坐標作圖,即得如圖8-12的標準曲線。
吸取待測液樣品5.00ml於50ml容量瓶中,加入顯色劑後定容,其方法與繪製標準曲線相同,測得吸光度為0.341。由標準曲線查得A為0.341時,c為6.60×10-3g.L-1。故樣品溶液中鐵離子的濃度為
c=6.60×10-3×50.00×1/5.00
=6.6×10-2(g.L-1)
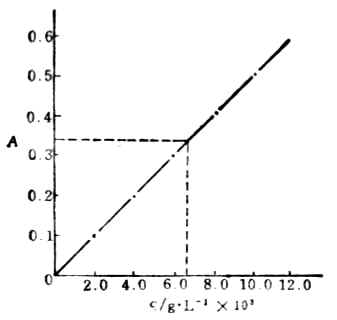
圖8-12 磺基水楊酸法測定鐵的標準曲線
| 關於「醫用化學/比色分析應用示例——鐵的含量測定」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |