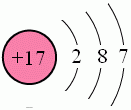氯
| A+醫學百科 >> 氯 |
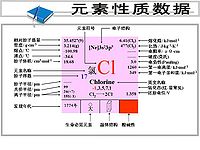
氯是一種鹵族化學元素,化學符號為Cl,原子序數為17,英文名:Chlorine(Cl)。氯常溫常壓下為黃綠色氣體。
目錄 |
基本信息
中文名:氯(lǜ)
元素原子量:35.45
折射率:(gas) 1.00077
原子化焓:kJ /mol @25℃121.8
熱容:J /(mol. K)(Cl2) 33.949
導熱係數:W/(m.K)8.9
熔化熱:(千焦/摩爾) 3.203
汽化熱:(千焦/摩爾) 10.20
原子體積:(立方厘米/摩爾)16.9
元素在宇宙中的含量:(ppm)1
元素在太陽中的含量:(ppm) 8
地殼中含量:(ppm)130
元素在海水中的含量:(ppm)18000
晶體結構:晶胞為正交晶胞。
氧化態:
主要: Cl-1, Cl+7
其它: Cl+1, Cl+3, Cl+4, Cl+5, Cl+6
化學鍵能: (kJ /mol)
Cl-O 206
Cl-Cl 242
Cl-F 257
Cl-H 431
晶胞參數:
a = 622.35 pm
b = 445.61 pm
c = 817.85 pm
α = 90°
β = 90°
γ = 90°
聲音在其中的傳播速率:(m/S)206
電離能 (kJ/ mol)
M - M+ 1251.1
M+ - M2+ 2297
M2+ - M3+ 3826
M3+ - M4+ 5158
M4+ - M5+ 6540
M5+ - M6+ 9362
M6+ - M7+ 11020
M7+ - M8+ 33610
M8+ - M9+ 38600
M9+ - M10+ 43960
元素類型:非金屬
發現人:舍勒 發現年代:1774年
發現過程:1774年,瑞典的舍勒用鹽酸和二氧化錳反應,製得氯氣;1810年由戴維確定了氯元素的存在。
元素性質
密度3.214克/升。熔點-100.98℃,沸點為零下34.6攝氏度。化合價-1、+1、+3、+5和+7。有毒,劇烈窒息性臭味。電離能12.967電子伏特,具有強的氧化能力,能與有機物和無機物進行取代和加成反應;同許多金屬和非金屬能直接起反應。氯是鹵族的一種普遍非金屬一價和高價元素,其最熟知的形式是重的、綠黃色、難聞的刺激性有毒氣體
製備
1、工業製法
通常用電解飽和食鹽水來製取,電解飽和食鹽水時,陰極出氫(放有石墨):2H2O+2e¨=H2↑+2OH¨,陽極出氯(放有鐵絲):2Cl¨=Cl2+2e¨。化學方程式為:2NaCl+2H2O=2NaOH+H2↑+Cl2↑。(條件:通電。)
2、實驗室製法
反應原理:在酸性條件下,用氧化劑氧化-1價的氯的化合物製得。實驗室中可以用濃鹽酸和二氧化錳共熱來製取,也可以用濃鹽酸和高錳酸鉀反應來製取。反應方程式:MnO2+4HCl=MnCl2+Cl2↑+2H2O。(條件:加熱。)或KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O。
用途
製造漂白粉、漂白紙漿和布匹、合成鹽酸、製造氯化物、飲水消毒、合成塑料和農藥等。提煉稀有金屬等方面也需要許多氯氣。
元素周期表中位置
第三周期 第Ⅶ(A)族
發現
1771-1774年間,舍勒將軟錳礦(MnO2)與濃鹽酸混合,放置在曲頸瓶中加熱,在接收器中獲得一種黃綠色氣體。該氣體具有和加熱的王水一樣的刺鼻嗅味,吸入後使肺部很難受。這使得舍勒製得了氯氣,並且研究了它的一些性質。
MnO2 + 4HCl(濃) ——→ MnCl2 +2H2O + Cl2 ↑(加熱)
儘管舍勒很早就製得了氯氣,但卻並沒有完全認識它的一些性質,所以他不但沒認為是找到了一種新的元素,還把氯氣當成了是氧的化合物——「氧化的鹽酸」。直到1810年,英國化學家戴維因「電解氯氣」失敗,確定了「氧化的鹽酸」氣是一種新元素,從希臘文chlōros(黃綠色)命名它為chlorine。它的拉丁名稱chlorum和元素符號Cl由此而來。
氯是自然界中廣泛分布的一種元素,在地殼中存在著各式各樣的氯化物,一個較強的氧化劑就能夠把

它從它的化合物中分離出來。因此它能夠在18世紀末,在科學家們發現氧、氮和氫等氣體的同時,製得了它的單質。但是由於一些荒謬的理論,妨礙了科學家們對它本質的認識,經過三十多年才確定它是一種元素。
氯,原子序數17,原子量35.4527,元素名來源於希臘文,原意是「黃綠色」。1774年瑞典化學家舍勒通過鹽酸與二氧化錳的反應製得氯,但他錯誤的認為是氯的含氧酸,還定名為「氧鹽酸」。1810年,英國化學家戴維證明氧鹽酸是一種新的元素,並定名。氯在地殼中的含量為0.031%,自然界的氯大多以氯離子形式存在於化合物中,氯的最大來源是海水。天然氯有兩種穩定同位素:氯35和氯37。
氯單質為黃綠色氣體,有窒息性臭味;熔點-100.98°C,沸點-34.6°C,氣體密度3.214克/升,20°C時1體積水可溶解2.15體積氯氣。
氯相當活潑,濕的氯氣比乾的還活潑,具有強氧化性。除了氟、氧、氮、碳和惰性氣體外,氯能與所有元素直接化合生成氯化物;氯還能與許多化合物反應,例如與許多有機化合物進行取代反應或加成反應。
氯的產量是工業發展的一個重要標誌。氯主要用於化學工業尤其是有機合成工業上,以生產塑料、合成橡膠、染料及其他化學製品或中間體,還用於漂白劑、消毒劑、合成藥物等。氯氣具有毒性,每升大氣中含有2.5毫克的氯氣時,即可在幾分鐘內使人死亡。
危險性
危險性類別:第2.3類 有毒(液化)氣體(高度危害(Ⅱ級)最高允許濃度1.0—<10mg/m3;中度危害(Ⅲ級))
危險性綜述:本品助燃、高毒,具刺激性,對環境嚴重污染,對水體可造成污染。
備註:液氯與氯水是不同物質。(液氯是純凈物,氯水是混合物)
不燃,但遇可燃物會燃燒、爆炸。
侵入途徑:吸入、眼睛及皮膚接觸。
健康危害:嚴重刺激皮膚、眼睛、黏膜;高濃度時,有窒息作用,引起喉肌痙攣,黏膜腫脹,噁心、嘔吐、焦慮和急性呼吸道疾病、咳嗽、胸痛、呼吸困難、支氣管炎、肺水腫、肺炎;甚至因喉肌痙攣而死亡。
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗。就醫。
眼睛接觸:提起眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸 入:迅速脫離現場至空氣新鮮處。呼吸心跳停止時,立即進行人工呼吸和胸外心臟按壓術。就醫。
食 入:無資料
接觸控制
中國MAC(mg/m3):1
前蘇聯MAC(mg/m3):1
美國TLV—TWA:OSHA1ppm,3mg/m3(上限值);ACGIHO0.5ppm,1.5mg/m3
包裝方法
氣瓶、移動式壓力容器(罐式集裝箱、罐式汽車、鐵路罐車)。
充裝量為500kg、1000kg的氣瓶裝運時,只允許單層放置,固定、防止滾動,瓶口一律朝向車輛行駛方向的右方。嚴禁與易燃物或可燃物、醇類、食用化學品等混運。夏季應早晚運輸,防止日光暴晒。公路運輸時要按規定路線行駛,禁止在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
最先發現氯的人
1774年,瑞典化學家舍勒最先發現了氯。當時他正在對軟錳礦的性質進行研究。他使用了部分鹽酸與這種礦石結合,結果釋放出一種刺激性、有窒息效果的氣味。社勒對這種氣體的性質進行了研究,發現它能腐蝕各種金屬,溶解性不強,能夠對彩色的花葉及綠葉起到漂白的作用。但社勒並沒有清晰地認識到這種氣體是一種新元素,而稱之為「脫烯素的鹽酸」。直到1810年,英國著名化學家戴維以充足的證據證明了這種氣體是一種新元素。由於它呈綠顏色,故而命名之為氯,原意即為「綠色的」。我國翻譯家最初根據原意把它譯成「綠氣」,後來才將二字合為一字棗「氯」。 氯是一種化學性質非常活潑的元素。它幾乎能跟一切普通金屬以及許多非金屬直接化合。氯多儲存在鋼筒中,這是因為乾燥的氯恰恰不與鐵發生反應。 在常溫和6個大氣壓下,人們可以將氯液化為一種黃綠色的液體,叫做「液氯」。 應當注意的是,氯有較強的毒性。如果空氣中含有萬分之一的氯氣,就會嚴重影響人的健康。一般認為,空氣中游離氯氣的最高含量也不得超過1毫克/立方米。 氯氣對人類的生產生活也有很大的價值。
分割線--------------------------------------------------------------------------------------------------------------------------------------------------------------
氯的自述①:我就是氯單質!具有強氧化性,普通人見了我必死無疑,希望有多餘電子的賢人志士來與我相結合!不勝感激!
Chlorine (from the Greek language Chloros, meaning "pale green"), is the chemical element with atomic number 17 and symbol Cl. It is a halogen, found in the periodic table in group 17. As the chloride ion, which is part of common salt and other compounds, it is abundant in nature and necessary to most forms of life, including the human body. As chlorine gas, it is greenish yellow, is two and one half times as heavy as air, has an intensely disagreeable suffocating odor, and is exceedingly poisonous. In its liquid and solid form it is a powerful oxidizing, bleaching, and disinfecting agent.
氯的自述②:下面我來介紹一下我的家庭:
我出生在鹵素家庭,家裡共5個兄弟,我排行老二。我大哥是氟(F),很雄的,在我們元素世家裡是最厲害的;三弟是溴(Br),像個女的般柔情似水,卻沒人喜歡他,因為他太臭了;四弟是碘(I),看起來是個硬傢伙,實際上根本惹不起別人,碰到特殊情況就變成一股紫煙逃之夭夭;小弟是砹(At),是個襁褓中的嬰兒,我們至今還沒看見過他的臉,只知道他在不斷的發出一種「光」。
我和氧姐姐生了五個兒子:(自豪啊,氟大哥只有一個兒子,溴和碘也不過各有四個。)
我的大兒子氯離子(Chloride ion: Cl-),他的孩子們是氯化物(Chloride),都很會游泳,大部分學過水下偽裝。
我的二兒子次氯酸根離子(ClO-),他的孩子們是次氯酸鹽(Hypochlorite),對別人的電子都很眼饞。
我的三兒子亞氯酸根離子(ClO2-),他的孩子們是亞氯酸鹽(Chlorite)。
我的四兒子氯酸根離子(ClO3-),他的孩子們是氯酸鹽(Chlorate),生氣起來就會把氧姐姐變出來嚇唬對方。
我的小兒子高氯酸根離子(ClO4-),他的孩子們是高氯酸鹽(Perchlorate)。
我的五個兒媳婦都是從氫家嫁過來的,分別是氫氯酸(Hydrochloric acid: HCl)、次氯酸(Hypochlorous acid: HClO)、亞氯酸(Chlorous acid: HClO2)、氯酸(Chloric acid: HClO3)和高氯酸(Perchloric acid: HClO4)。
我有幾個女兒,都嫁到了氧家。我的大女兒是一氧化二氯(Dichlorine monoxide: Cl2O),二女兒是二氧化氯(Chlorine dioxide: ClO2),三女兒是七氧化二氯(Dichlorine heptoxide: Cl2O7)。
此外,氟大哥和我在嘗試克隆時弄出了三個怪胎:一氟化氯(Chlorine monofluoride: ClF),三氟化氯(Chlorine trifluoride: ClF3)和五氟化氯(Chlorine pentafluoride: ClF5)。我還有個私生子叫氯胺(Chloramine: NH2Cl)。
下面是我四個兒媳婦的檔案(簡介氯的含氧酸):
1. 次氯酸(HClO)及其鹽
(1) 製備
①通氯氣於冰水中:Cl2 + H2O = HClO + HCl
②通氯於鹼液中可得次氯酸鹽:Cl2+ 2NaOH → NaClO + NaCl + H2O
③工業上用電解冷濃食鹽水並劇烈攪拌來製備NaClO
(2)性質
①是弱酸,但為很強的氧化劑,且具有漂白性
②受熱易發生氧化還原反應
3ClO-→ ClO3- + 2Cl-
(3) 用途:製造漂白粉Ca(ClO)2
漂白粉: Cl2與Ca(OH)2反應 2Cl2 + 2Ca(OH)2 → Ca(ClO)2+ +CaCl2 +2H2O
2. 亞氯酸(HClO2)及其鹽
亞氯酸是目前所知唯一的亞鹵酸,非常不穩定。
(1) 製備
①ClO2在水中分解:2ClO2 + H2O → HClO2 + HClO3
②通ClO2於Na2O2或NaOH與H2O2可得亞氯酸鹽
2ClO2 + Na2O2 → 2NaClO2 + O2;2ClO2 + H2O2 + OH-→ 2ClO2- +O2 + H2O
(2) 性質與用途
①非常不穩定的化合物,但亞氯酸鹽較穩定。
②具有漂白性
3. 氯酸(HClO3)及其鹽:濃度高於40%則不穩定
(1) 製備
①次氯酸根水溶液加熱,產生自身氧化還原反應(歧化反應):3ClO-→ ClO3- + 2Cl-
②電解熱氯化鈉水溶液並加以攪拌:3Cl2 + 6OH- → ClO3- + 5Cl- + 3H2O
(2) 性質及用途
①氯酸和氯酸鹽皆為強氧化劑
②氯酸鉀用於製造炸藥
③KClO3受熱反應
A.無催化劑,不可加強熱:4KClO3 → 3KClO4 + KCl (約100℃)
B.催化劑(MnO2):2KClO3 → 2KCl + 3O2↑ (約300℃)
4. 高氯酸(HClO4)及其鹽
(1) 製備
①低壓蒸餾KClO4與H2SO4的混合液:KClO4 + H2SO4 → HClO4 + KHSO4
②電解食鹽水時,陽極產生的氯氣被氧化:1/2Cl2 + 4H2O → ClO4-+ 8H+ + 7e-
③氯酸鹽受熱分解:4KClO3 → 3KClO4 + KCl
(2) 性質與用途
①最穩定的含氧酸,不易分解
②非常強的酸
<版權所有,等電子的氯,2006.2>
啊~寫漏了
氯化物應該是「除了氯化銀外都學過水下偽裝」作者: 等電子的氯 2006-2-12 13:12
氯化物除了氯化銀和氯化亞汞外都溶於水,氯化亞汞比氯化銀更不易溶於水
氯的簡介
氯是人體必需常量元素之一,是維持體液和電解質平衡中所必需的,也是胃液的一種必需成分。自然界中常以氯化物形式存在,最普通形式是食鹽。氯在人體含量平均為1.17g/kg,總量約為82-100g,占體重的0.15%,廣泛分布於全身。主要一氯離子形式與鈉、鉀化合存在。其中氯化鉀主要在細胞內液,而氯化鈉主要在細胞外液中。
氯的發現
1771-1774年間,舍勒將軟錳礦(MnO2)與鹽酸混合,放置在曲頸瓶中加熱,在接收器中獲得一種黃綠色氣體。該氣體具有和加熱的王水一樣的刺鼻嗅味,吸入後使肺部很難受。這使得舍勒製得了氯氣,並且研究了它的一些性質。儘管舍勒很早就製得了氯氣,但卻並沒有完全認識它的一些性質,所以他不但沒認為是找到了一種新的元素,還把氯氣當成了是氧的化合物—「氧化的鹽酸」。直到1810年,英國化學家戴維確定了「氧化的鹽酸」氣是一種新元素,從希臘文chlōros(黃綠色)命名它為chloine。它的拉丁名稱chlorum和元素符號Cl由此而來。
食物來源
膳食氯幾乎完全來源於氯化鈉,僅少量來自氯化鉀。因此食鹽及其加工食品醬油、腌制肉或煙熏食品、醬菜類以及鹹味食品等都富含氯化物。 一般天然食品中氯的含量差異較大;天然水中也幾乎都含有氯。
生理功能
1.維持體液酸鹼平衡。
2.氯離子與鈉離子是細胞外液中維持滲透壓的主要離子,二者約佔總離子數的80%左右,調節與控制著細胞外液的容量和滲透壓。
3.參與血液CO二價離子運輸。
4.氯離子還參與胃液中胃酸形成,胃酸促進維生素B12和鐵的吸收;激活唾液澱粉酶分解澱粉,促進食物消化;刺激肝臟功能,促使肝中代謝廢物排出;氯還有穩定神經細胞膜電位的作用等。
需要人群
大量出汗、腹瀉嘔吐、腎功能異常及使用利尿劑、肺心病時會導致氯丟失、引起氯缺乏和血漿鈉氯比例改變。
生理需要
我國目前尚缺乏氯的需要量的研究資料,難於制定EAR和RNI,根據氯化鈉的分子組成,結合鈉的AI值,我國提出中國居民膳食適宜攝入量(AI)為3400mg/d。
過量表現
人體攝入氯過多引起對機體的危害作用並不多見。僅見於嚴重失水、持續攝入高氯化鈉或過多氯化銨;臨床上可見於輸尿管-腸吻合術、腎功能衰竭、尿溶質負荷過多、尿崩症以及腸對氯的吸收增強等,以上均可引起氯過多而致高氯血症。此外,敏感個體尚可致血壓升高。
缺乏症
氯的缺乏常伴有鈉缺乏,此時,造成低氯性代謝性碱中毒,常可發生肌肉收縮不良,消化功能受損,且可影響生長發育。
攝取提示
飲用含氯的水最好能吃一些酸乳酪和維生素E,因為酸乳酪能補充被氯殺死的腸內有益菌,而維生素E能補充被氯破壞掉的部分。
氯元素的兩種天然同位素:
氯元素有兩種天然同位素35CL和37CL:
氯元素的相對原子質量:
氯原子中質子數與中子數都為整數,為什麼氯元素的相對原子質量為35.5呢?
自然界中一種元素有多種原子,它們的質子數相同,中子數不同。這些元素互稱同位素。不管是在單質還是化合物中,同位素的原子總按一定丰度共存。
氯元素相對原子質量的計算方法是:各同位素的相對原子質量乘以各同位素原子的丰度之和,即:34.969×0.7577+36.966×0.2423=35.453。
嚴格地說.質子數與中子數相加,只能表示某一種原子的質量數。元素的相對原子質量是考慮到這種元素的原子種類,每一類原子在元素中的含量以及各原子的質量後,計算出的平均值。
任何一種元素的相對原子質量與其中一種原子的質量數都有差異。
參看
|
|||||||||||||||||||||||||||
|
||||||||
| 關於「氯」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |